원자가 결합 이론 Valence Bond Theory ( <-> Molecular Orbital Theory)
원자들이 모여서 화합물을 이룰 때 어떤 조합으로 화합물을 형성하고 그 화합물의 기하학 구조는 어떠한가?에 대해 얘기하는 게 원자가 결합 이론!
만들어진 화합물 분자들의 들어가진 물리적 성질, 공간 화학적 성질은 원자가 결합 이론만으로 설명이 어렵지만 분자궤도함수 이론을 사용하면 알 수 있다. 하지만 분자궤도함수 이론은 원자들이 모여 화합물을 형성할 때 어떤 조합으로 어떤 기하구조로 말할 때 조금 더 불리하며 원자가 결합 이론이 더 유리함! 탄소와 산소로 이루어진 분자가 있을 때 이들로 이루어진 분자들은 CO와 CO2가 있다. CO3가 되려고 하면 CO2- 이온이지 분자가 아닙니다. C2O2, C2O4, CO4 분자는 본 적이 없는데 왜 그런지에 대해 원자가 결합 이용, 루이스 구조, 옥텟 규칙 등이 유용한지! CO2가 굽은 형태가 아닌 선형 분자 인지는 VSEPR이 잘 설명해 줄 것임.
원자가 결합 이론은 1900년대 초반 루이스에 의해 정립되었습니다.
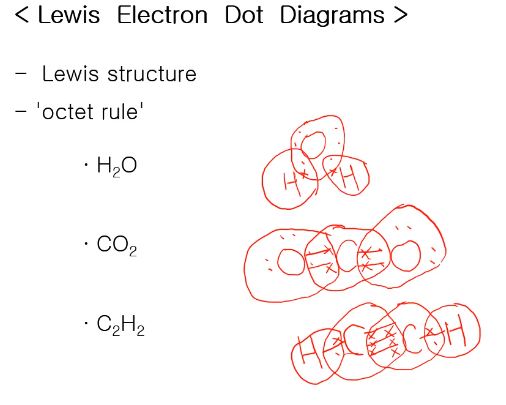
루이스 닷 다이어그램, 루이스 스트럭처를 그려서 어떤 화합물이 안정한지 확인할 수 있다. 루이스 구조를 그려 옥텟 규칙을 만족시킬 수 있는지 확인할 수 있습니다. 옥텟은 원자 위에 8개 전자를 갖고 있을 때 안전하다!
주족원소들은 최외각전자가 s와 p 오비탈에 채워지고 가득 차면 8개의 전자가 채워진 상태가 되는 것! 비활성기체의 전자배치를 갖게 되는 거고 그래서 안정하며 그 화합물은 안정한 화합물이 된다고 말할 수 있다.
- H2O의 중심은 O이며 화합물에서 중심 원자는 가장 일렉트로 포지티브 한 게 중심이지만 일부 예외도 있다.
이 경우도 O가 H보다 더 네거티브 하지만 중심 원자가 된다.
O 원자는 16족 원소로써 자기 주변에 6개 전자를 갖고 있음. 이 O 원자가 최외각 전자 1개 있는 수소 두 개와 만나게 되면 수소 원자로부터 전자 1개씩을 받아 자기 주위에 8개를 갖고 옥텟 규칙을 지키며 수소는 2개밖에 갖고있지 못 하지만 수소는 1s 만 있으므로 2개면 다 차고 안정하게 된다.
수소와 산소로 이루어져 있는 화합물로서 H2O, H2O2 이 정도가 가능하며 H3O는 옥텟 규칙을 만족시키는 루이스 구조를 갖기 위해서는 H3O+양이온이 되어야 한다. 화합물이 형성이 될 때 어떤 조합으로 안정한 화합물이 되는지... 중성분자가 아니면 양, 음이온이 든지 될 수 있다.
- CO2 분자의 경우 일반적으로 일렉트로 포지티브 한 C가 중심 원자가 되며, C는 14족 원소로 4개의 전자가 있고, O는 6개로 전자를 서로 공유하면 위 그림과 같다. 각각 8개씩 가지며 옥텟 규칙을 만족시켜 안정하게 된다. O=C=O 이중결합이 선형을 ...
- C2H2 경우는 C가 각각 4개의 전자를 갖고 있으면서 3개를 공유하고 각각 수소와는 1개씩 받아 C 주변은 8개로 옥텟 규칙을 H는 2개로 전자껍질을 다 채워 안정하다.
확장된 전자껍질(expanded shells)
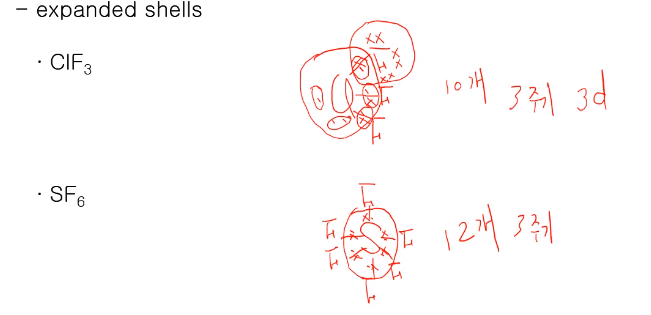
일반적인 분자들은 옥텟규칙을 만족시키지만 일부에서 확장된 껍질을 사용함에 따라 옥텟 규칙을 만족 못 시켜도 안정한 분자가 있다.
-ClF3 Cl이 더 일렉트로 포지티브 해서 중심 원자가 되고 Cl은 주변에 7개 전자가 3개의 F와 결합하는데 F 또한 17족 원소로 7개의 전자가 있는데, 7개의 전자가 Cl의 전자 1개씩 결합하여 옥텟 규칙을 만족하며 Cl 주위에는 3쌍의 본딩 페어와 2쌍의 논 페어가 있어서 총 10개의 전자를 갖고 옥텟 규칙을 만족시키지 못하지만, 확장된 껍질을 사용하여 안정한 루이스 구조를 갖는다.
Cl처럼 3주기 원소들은 d 오비탈이 비어 있어 그 d 오비탈에 전자가 차면서 안정하게 된다.
결합하는 치환기 원자 중 3주기 이상이면 8개 보다 더 많은 전자를 수용할 수 있다. 4주기면 4d 5주기면 5d 등등!
그러나 지나치게 많아지면 안정하지 않다.
-SF6는 포지티브 한 S가 중심 원자이며 그 주위의 6개의 F가 배열되는데 S는 16족 원소로서 6개의 전자가 있고 F와 전자 1개씩을 공유함으로 12개의 전자를 갖게 되고 SF 결합은 모두 단일 결합이다. 12개 전자를 가지며 옥텟 보다 4개 더 많이 있다. S 오비탈도 3주기로 3d 오비탈이 있어 확장된 껍질을 사용한다.
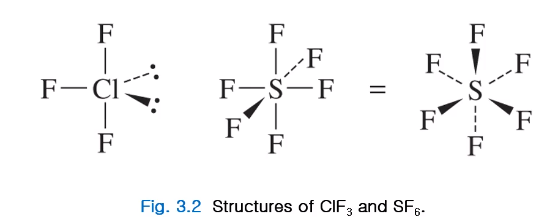
분자구조는 위 사진과 같은데 이 분자 구조는 루이스 구조만 그려서, 루이스가 옥텟을 만족하는지, 확장된 껍질을 사용한다 해도 분자 구조가 어떻게 됐는지는 VSEPR 이론을 갖고 더 자세히 알 것이다.
ClF3 논페어 두 개가 캐터럴 위치 오니 T shape이고 SF6 경우 본딩 페어 6개를 반발을 최소화하면서 배치하는 방법으로 8면체 기하구조이다.
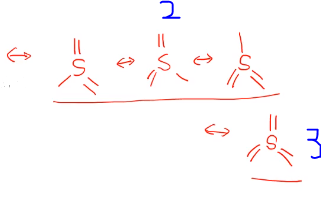
공명(Resonance)
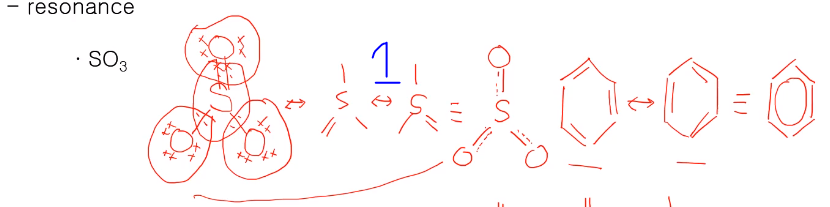
공명하면 벤진을 많이 떠오를 텐데 공명 구조로 어느 하나의 구조로 말할 수 없고 위 그림과 같이 두 가지 공명 구조 형태로 표현할 수 있다.
어느 한 쪽으로 localized 되어 있지 않고 delocalized 되어 있다.
하나의 루이스 구조로 분자구조를 나타낼 수 없을 때 여러 개의 루이스 구조가 공명을 함으로써 분자구조를 나타내게 됩니다.
SO3 경우에도 S가 중심에 있고 O 3개가 위의 구조처럼 전자배치가 될 수 있다.
3개 중 한 개만 이중 결합이 있는데 실제는 3개의 결합이 동일한 결합입니다.
즉, 이중결합이 한 곳에만 localized 된 게 아니라 delocalized 되어 있어 서로 다른 공명 구조가 가능하여 벤진처럼 공명 구조 표시인 점선으로 1.xxx 결합을 나타낸다. SO3는 중심 원자 S가 3주기이므로 반드시 옥텟 규칙을 만족시킬 필요도 없습니다. 공명에서 기여도 중요도 얘기를 하는데 실제 공명 구조에서 각 공명 구조가 얼마나가 기여를 하고 얼마나 중요한가 했을 때 위 그림의 루이스 옥텟을 만족하는 1, 그다음 2, 가장 기여도 낮은 게 3이며 형식전하를 이용해서 알 수 있다. 공명은 하나의 루이스 구조로 실제 구조를 나타낼 수 없을 때 여러 개의 루이스 구조를 써야 하면 공명 구조라고 한다.
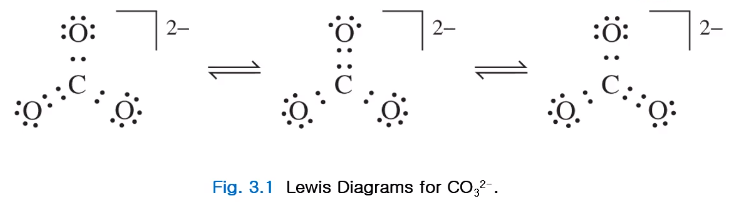
등전자성(Isoelectronic)
SO3와 같이 분자끼리 같은 전자구조를 갖는 것을 등전자성이라한다.(15족 질소가 중심되면 하나를 얻어야 하고 14족 탄소가 되면 두 개를 얻어야 한다.)
극성 결합 & 비극성 결합(porlar bonds & nonpolar bonds)
극성결합은 서로 다른 두 원자 사이의 결합 두 원자의 전기음성도(전자를 자기 쪽으로 당기는 힘) 가 크면 자기 쪽으로 전자를 잡아당겨 극성이 생김!
비극성 결합은 같은 원자로 이루어진 결합은 N2, O2 같은 경우는 어느 한 쪽으로 전자가 쏠리지 않으면 비극성이라 한다.
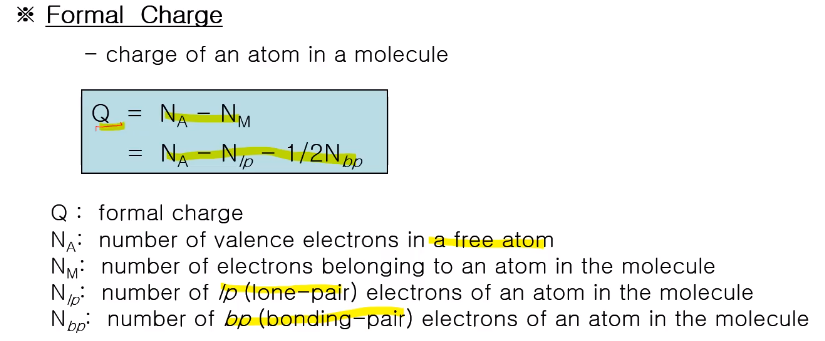
*형식전하 (Formal Charge)
실제로 전하가 존재하지는 않지만 형식적으로 존재하는 전하다.
분자(이온) 내에서 특성 원자의 형식전하는 Q=Na-Nm으로 표시한다.
Na: 분자를 형성하지 않은 독립된 원자에서의 원자가전자의수 질소는 15족 원소로서 밸런스 일렉트론이 5개죠 이게 곧 Na다.
Nm: 분자 속에 있는 전하! Nlp+Nbp가 되는 것이다.
lp 전자는 이 결합 전자로 그 원자핵에만 있는, 그 전자 개수는 다 카운팅 하는데 bp는 결합 전자로 한 개씩 공유하니 1/2가 되는 것이다.

형식전하 Q를 제대로 구했는지 확인하는 방법은 중성분자면 차지가 0 이온이면 +1,2 -1,2 등등 될 수 있고 이 값과 분자 내에 모든 원자들의 형식전하를 합친 것과 같아야 합니다.
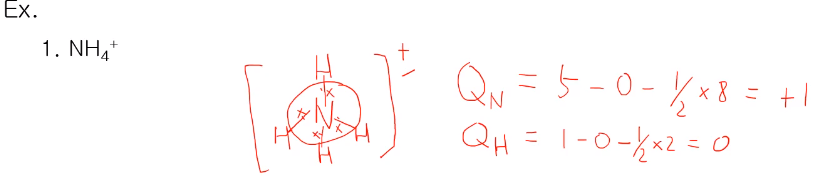
형식전하를 알기 위해서는 루이스 구조를 알아야 합니다.
중심 원자가 N, 주위에 H4개가 있고, N 15족으로 5개의 전자가 있어 H와 결합을 4개만 사용하고 1개는 잃어버려야 옥텟 규칙을 만족한다.
N의 형식전하 QN는 15족이니 Na=5, lp=0, bp=8 Qn= Na-Nlp-1/2Nbp= 5-0-1/2x4=+1
수소는 QH=1-1/2x2=0
수소 4개, 질소 1개의 형식전하를 다 더해보니 +1로 맞다.
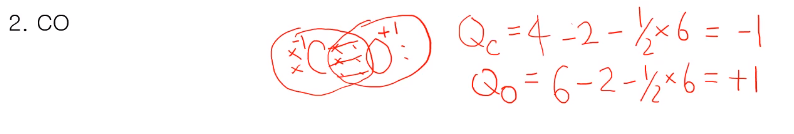
CO는 탄소가 전자 4개 중 2개를 산소 6개 중 4개를 공유해서 결합하여 각자 옥텟 규칙을 만족한다. 탄소의 형식전하는 QC=4-2-1/2x6= -1 / 산소의 형식전하는 QO=6-2-1/2x6=+1 두 형식전하를 더한 값과 CO가 중성 분자로서 차지가 0인 게 같은 걸로 보아 형식전하를 잘 구했다. 형식전하를 나타낼 때 원자 위의 +,- 표기도 해준다.
일렉트로 포지티브 한 C의 형식전하가 -가 있고 일렉트로 네거티브한 O의 형식전하가 +가 있는데, 일렉트로 네거티브의 경우 -를 가질수록 안정하고, 포지티브는 +를 갖고 있어야 안정하다. 그런 면에서 CO 분자가 불안정하다는 것을 알 수 있다.(형식전하로 안정한지도 알 수 있다.) CO는 CO2에 비해 불안정하여 산화하여 CO2로 가려 한다.
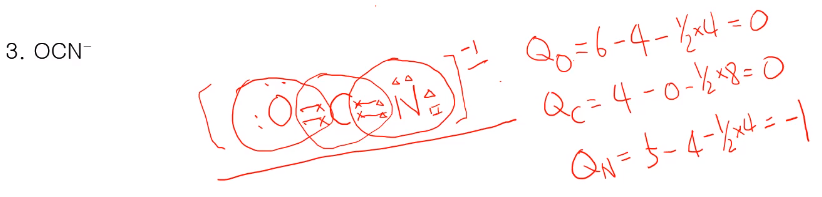
OCN은 C가 중심 원자이고 C는 4개, O는 6개, N은 5개로 위 그림과 같이 있다. N이 옥텟 규칙을 만족하기에 1개가 부족하다 그래서 전자 한 개를 받아 1가 음이온이 되면 모든 원자 주위 8개의 전자를 가지며 옥텟을 만족한다.
O 원자의 형식전하 QO=6-4-1/2x4=0
C 원자의 형식전하 QC=4-0-1/2x8=0
N 원자의 형식전하 QN=5-4-1/2x4=-1
이들 다 합친 값은 -1이고 분자의 차지도 -1로 동일한 것을 볼 수 있다.
'무기화학' 카테고리의 다른 글
| 무기화학 원자가 결합 이론 [Simple Bonding Theory (VSEPR)] #8 (0) | 2021.12.08 |
|---|---|
| 무기화학 원자가 결합 이론 [Simple Bonding Theory(VSEPR)] #7 (0) | 2021.12.07 |
| 무기화학 원자 구조 친화도, 주기 [Atomic Structure (affinity, period)] #5 (0) | 2021.12.03 |
| 무기화학 원자 구조 가리움 [Atomic Structure(shielding)] #4 (0) | 2021.12.02 |
| 무기화학 오비탈 이론 #3 (0) | 2021.12.01 |