
다음 룰과 같이 있다.
1. 낮은 n 값은 안정하고 에너지가 낮다.
2. 궤도함수의 타입의 l 값에 따라 결정된다.
3. 오비탈의 종류는 2l+1 값만큼 있다.
4. n 차의 에너지 레벨에는 n 타입의 오비탈이 있다. n이 3개일 경우 s, p, d 3가지 종류 오비탈 있다.
5, 6 은 노드 개수에 대한 공식이다. 3p 오비탈은 n 값은 3이고 l 값이 1이니까 3 - 1 - 1이다.
7. 서로 다른 스핀양자수 ms가 있다.


파울리베타원리는 원자 내 전자는 독특한 세트의 양자수를 갖는다.
다른 말로 어떤 두 원자도 네 개의 양자수와 동일할 수 없다.
ex 전자가 두 개가 있는데 서로 다른 스핀 양자 수여야 한다. 하나가 up 이면 다른 하나는 down!


*표시는 쌓음 원리에 의해서 규칙적으로 채워지지 않는 전자배치입니다.
아우프바우 따르면 크롬 경우 4s에 전자 두 개 다 채우고 3d에 4개가 되어야 한다.
모든 전자배치를 다 적으면 너무 많으니 비활성 기체의 전자배치를 간단히 적고 추가로 적는다.
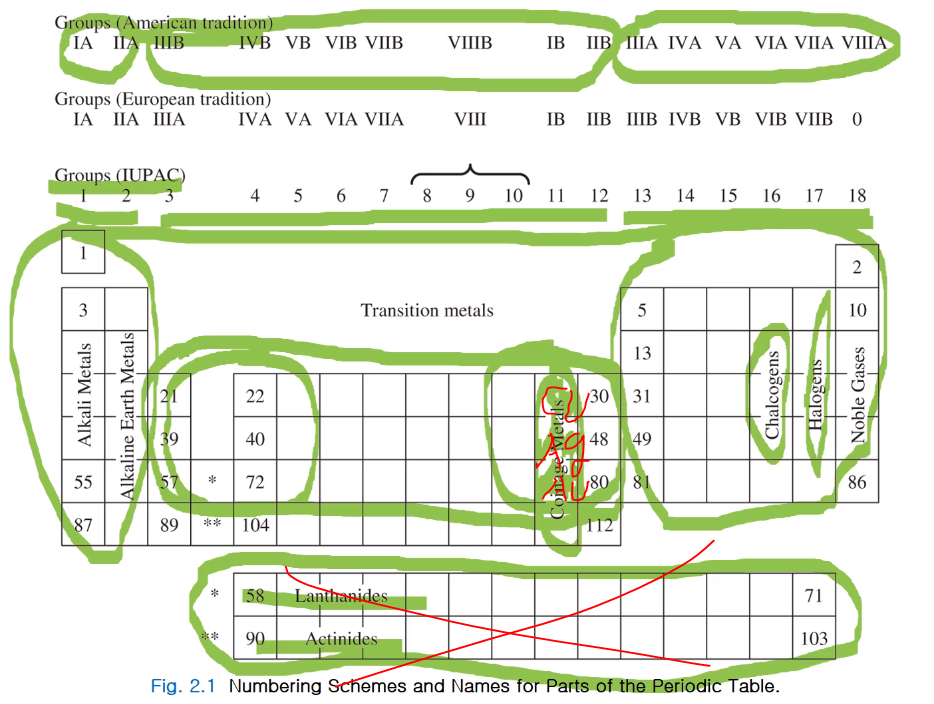
주기율표 전부다 외우는 건 중간고사 1번 문제.... 그러니 다 외우렴~
Lanthanides, Actinides는 빼고 다 외워야 해~ 오!! 88번 까지는 다 외워~
1족 알칼리
2족 알칼리 토금속
앞쪽 전이는 ealry transmetals, 뒤 쪽은 late trans metals
11족은 동전 만드는 금속으로 coinage metals이라고 한다.
13족 붕소족, 14족 탄소족, 15족 질소족, 16족 산소족 산소 외에는chalcogens이라한다.
17족 할로겐, 19은 비활성 노블 가스라 한다.
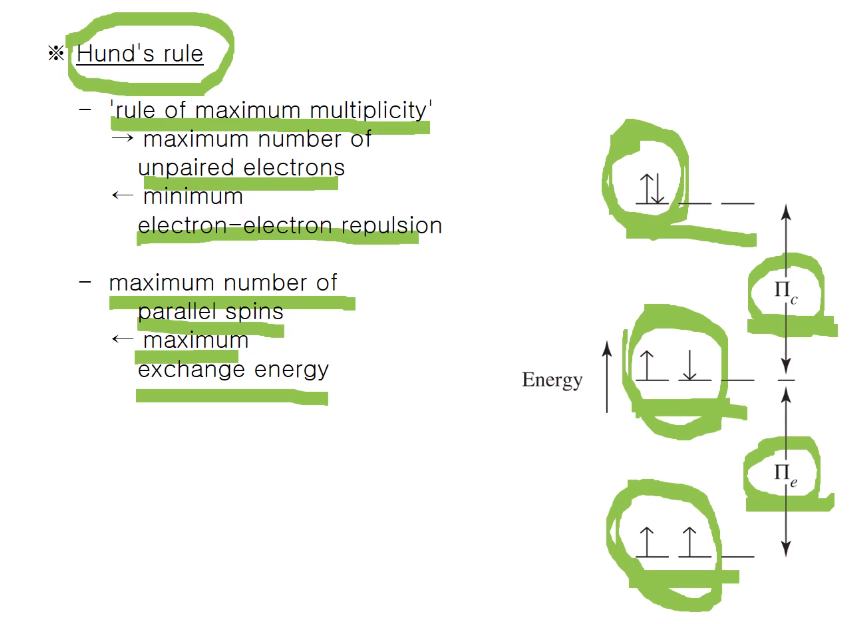
전자 채워지는 방법은 위와 같은 3가지 방법이 있는데
훈트의 규칙에 다른다. 최대 다중도의 법칙이라고 하고 홀전자의 수를 최대로 하고 방향은 같도록~
쌍을 이루고 있으면, pie c (쿨롱 인터랙션 반발 에너지)가 있다.
pie는 교환 에너지로 안정화 에너지입니다. pie e가 있어야 안정화 해지고 pie c는 없어야 안정화된다.
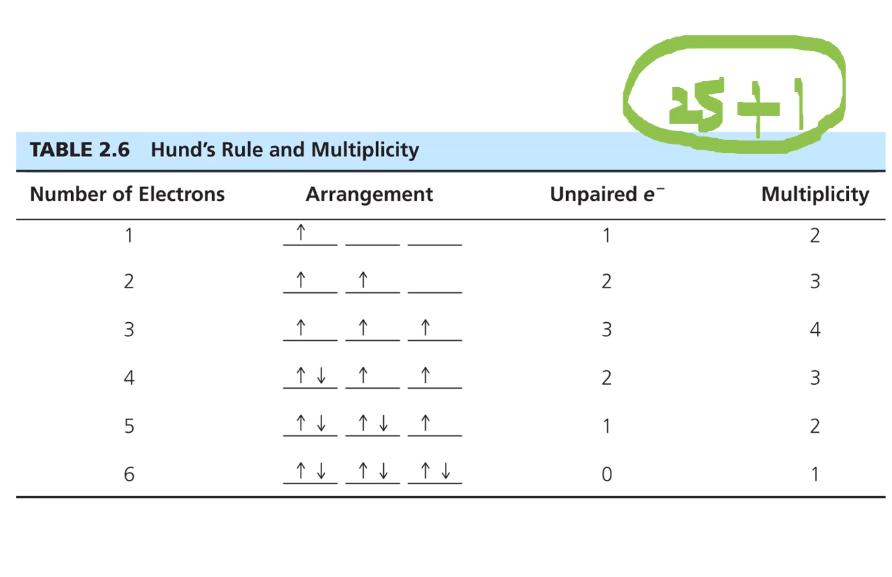
스핀다중도는 홀전자 개수에 1을 더한 거다.
2s+1으로 (s 는 0.5 unpaired e- 이다.)

산소에서 두 번째 것이 더 낮은 에너지를 같다. pie c, e를 비교해서 c가 더 적고 e가 더 많은 쪽이 안정하고 더 낮은 에너지를 갖는다.
질소에서도 마찬가지로 pie c, e 비교를 해서 알 수 있따.
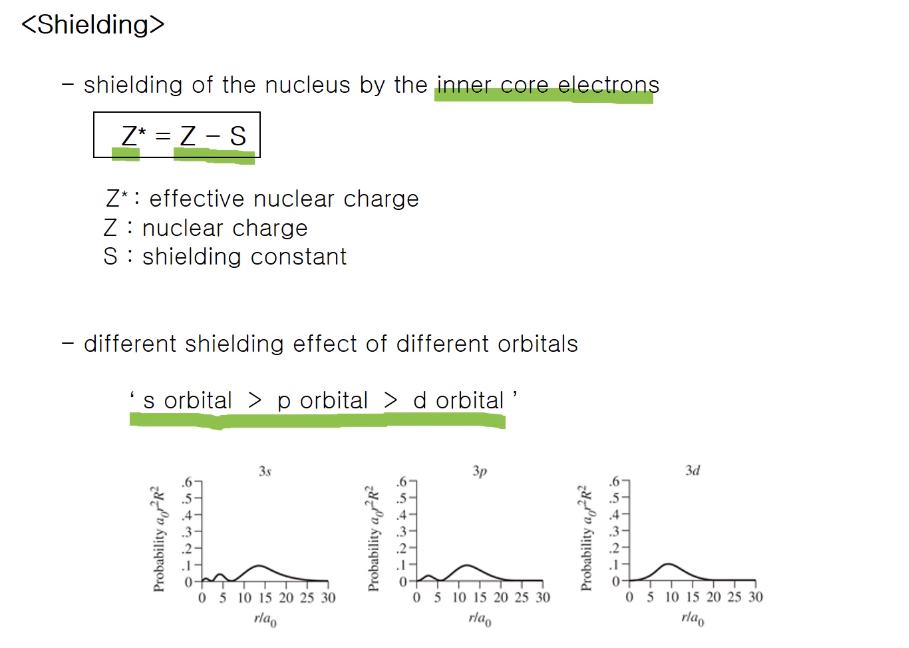
가려막기(shielding)
: 내부 전자들에 의해 핵이 가려지는 것! 핵을 가려줌으로 인해 최외각 전자가 느끼는 핵의 전하는 낮아지고,
실제 느끼는 게 유효 핵전하라 하며 Z* = Z-S로 표기한다.
s 오비탈이 p, d 보다 핵의 더 침투되어 있어서
즉, 핵에 더 가까이 얼마나 많은 전자가 있냐에 따라 가리움이 달라진다.
전자를 발견할 확률이 가장 높은 지점은 d 오비탈이지만 비록 적은 양이라도 핵에 가까이 있는 부분이
더 많이 있는 것이, 핵을 더 많이 핵 쪽으로 더 많이 침투하는 것이 핵을 더 잘 가려준다.
그러므로 s 오비탈이 p보다 p가 d 보다 더 잘 가려준다.
Slater's rule
가려막기 상수 shielding constant는 정확한 값은 양자 화학적 계산을 통해 얻어낼 수 있지만 간단한 수식을 통해 알 수 있다.


ex (4s, 4p)에 최외각이 있다면, (4s, 4p)는 0.35만큼 n-1인 (3d), (3s, 3p)는 0.85, (1s), (2s, 2p)는 1.00만큼 2번 규칙인 (5s)는 가리움이 0이다.

'무기화학' 카테고리의 다른 글
| 무기화학 원자가 결합 이론 [Simple Bonding Theory] #6 (0) | 2021.12.05 |
|---|---|
| 무기화학 원자 구조 친화도, 주기 [Atomic Structure (affinity, period)] #5 (0) | 2021.12.03 |
| 무기화학 오비탈 이론 #3 (0) | 2021.12.01 |
| 무기화학 원자구조(Atomic Structure) #2 (1) | 2021.11.30 |
| 무기화학 Introduction to Inorganic Chemistry #1 (0) | 2021.11.29 |