
형식 차지의 OCN-경우 루이스 스트럭처가 가능하고 O, N, C의 포멀 차지를 알아봤다. A 공명 구조에 있어서 O, C는 중성이고 N은 1- 포멀 차지를 갖는다.
A의 구조만 옥텟 규칙을 만족시키는 구조가 아니라 B와 C의 경우도 옥텟 규칙을 만족시키는 공명 구조입니다. B의 경우에는 N 주위에 5개가 있고 탄소와 결합으로 총 8개 C 주위 4개의 전자가 있고 N, O와 결합으로 8개 O 전자에는 6개가 있는데 외부에서 1개 받고 C와 결합으로 전체가 옥텟 규칙이 만족된다. 구성원자 들의 포멀 차지를 보면 C, N은 0이고 O는 1-이다. C의 공명 구조에는 O 주위의 6개의 전자가 있어 탄소와 결합해 8개를, C 주위의 4개 N, O와 결합해서 8개, N 주위 5개에 외부에서 추가되는 전자 하나가 마이너스 이온으로 들어오면 이 경우에도 각각의 원자 주위의 8개의 전자를 가지며 옥텟 규칙을 만족한다. 단순히 형식전하로만 보면 가장 전기음성도가 큰 O의 -형식전하가 있는 B가 안정할 것으로 보이는데, 물론 형식전하는 가능하면 낮을수록 안정한 공명 구조가 된다. 2-이상 형식전하를 갖는 공명 구조는 안정하지 못해 기여도가 떨어집니다. A, B는 둘 다 형식전하가 1- or 0로 똑같으니 보다 전기음성도가 큰 원자 O가 -형식전하가 있으니 B가 더 안정하고 기여도가 크다고 할 수 있지만!
실제로 OCN 결합길이를 조사해보면 O=C=N은 이중결합에 가까운 결합으로 보이고 A의 기여도가 B보다 비슷하지만 A가 약간 더 크다고 할 수 있다. (형식전하를 갖고 일반적으로 공명 구조의 기여도 및 안정도를 판단하는 기준에 대해 약간 예외적이긴 하지만.... N도 상당히 전기음성도가 커 기여도가 그렇게 차이가 나지 않고, 전자가 C 주위에 이중결합으로 고루 분포해 있는 점도 있고 해서 실제 분자에서는 A가 기여도가 더 크다.)

형식전하와 확장된 껍질로 중심 원자가 3주기 이후의 원소인 경우에 그냥 옥텟을 만족시키는 그런 구조에서 이들이 갖는 형식전하가 어떻게 되나 했을 때!!! 그림 위 다섯 가지 분자로 알아볼 것이다. 친숙한 황산이온은 S 주위 8개로 옥텟 규칙을 만족한다고 봤을 때 S의 형식전하는 2+와 같다. 그 외에 다른 분자도 옥텟을 만족시킬 때 1+~3+ 범위를 갖고 큰 형식전하를 가져 안정하지 못한 편이다. 그 반해서 확장된 껍질을 써서 옥텟보다 더 많이 10~14개 전자를 갖는 경우에는 형식전하가 보통 0으로, 형식전하를 최소화하는 공명 구조로 더 안정하고 기여도가 크게 된다. 황산이온의 경우 안정한 루이스 구조를 그라고 하면 확장 껍질 모양으로 그리게 되며 S는 0이고 O는 단일 결합은 -1, 이중은 0! 옥텟 만족하는 경우에 비해 형식전하가 적어 더 안정한 공명 구조라 할 수 있고 실제 분자구조도 이것들과 가깝다. 확장된 껍질을 썼을 때 어떻게 형식전하가 줄어들고 어떻게 안정화되는가 이런 자료를 통해 알 수 있다.

베릴륨과 보론 화합물의 경우에는 2족과 13족 원소로써 자기 주위에 전자가 2~3개밖에 없기 때문에 옥텟 규칙을 만족시키기 어렵습니다. 이런 경우 어떻게 자기 주위에 8개의 전자를 가지며 안정한 화합물을 만들는가? 다중결합을 가지거나 자기 주위의 네트워킹을 해서 여러 결합을 통해 옥텟을 만족시킬 수 있습니다. 베릴륨 경우 F2 화합물이 있는데 자기 주위의 2개의 전자가 있을 때 나머지 전자들은 F로부터 3개를 받아 주위 8개의 전자를 만족할 수 있다.
그래서 베릴륨과 F 경우 이중결합을 통해 옥텟 규칙을 만드는다. 실제 BF2 경우 형식전하가 베릴륨은 2-, F는 1+ 형식전하를 갖는 형태로 오히려 전기음성도가 큰 F가 +를 갖고 있고 베릴륨도 높은 수의 형식전하를 갖고 있어 불안정하다. 형식전하 문제는 해결 안 되지만 고체 상태가 되면 서로 네트워킹이 하면서 베릴륨 주위의 결합이 4개로 되어 있어 옥텟을 만족시킨다. 두 개는 공유하고 두 개씩은 일방적으로 받아 옥텟을 만족! 그러나 베릴륨 형식전하는 똑같아 안정하지는 않지만 네트워킹 통해 조금 더 분자로 독립보단 안정한 상태로 돼서 실제 고체로 이런 구조를 갖는다. 베릴륨 Cl2 경우도 비슷하게 옥텟을 만족시킨다! 고체의 경우에는 1차원 사슬형태로 베릴륨 주위의 4개의 결합이 생긴다.(높은 온도 기체 상태에서는 다이머(이합체)는 이중결합한 상태보다 안정하다.) 독립된 분자는 형식전하가 크고 전기음성도가 큰 F, Cl에 -가 아닌 +형식전하가 있어서 형식전하 관점에서 보면 위배되는 경우이다. BF3 경우는 B는 13족 원소로 자기 주위의 3개의 전자를 갖고 있고 이 3개의 전자가 F에서 제공되는 전자와 함게 모두와 옥텟을 만족한다. 어느 한 결합만 이중이고 나머지는 단일인데 한쪽으로 고정이 아니라 공명! BF3 분자 단일결합이면 152pm인데 실제 분자 결합길이는 131pm으로 어느 정도 이중결합보단 길고 단일보단 짧은 공명 구조임을 알 수 있다.

원자가결합이론의 두 번째로 중요한 'VSEPR 이론'! (원자가 껍질 전자쌍 반발 이론) 분자 구조를 알기 위해서는 VSEPR 이론을 적용해서 분자구조를 예상 및 확인을 할 수 있다.
1. 전자쌍 간의 반발을 최소화하는 기하구조를 갖는다!
입체수라는 것을 정의를 하는데! 중심 원자 주위의 전자쌍 개수(본딩, 론 페어)에 따라 Geometry가 바뀐다.
2. 반발에 있어서 반발의 크기가 lone pair - lone pair >> lone pair - bonding pair > bonding pair - bonding pair 순으로 된다.
본딩 페어는 두 원자 사이의 붙잡혀 있어 상대적으로 공간을 덜 차지해서 반발도 더 적다. 하지만 론 페어는 하나의 원자에만 포함되기 때문에 전자가 멀리 넓게 분포하고 서로 이들끼리 쉽게 겹쳐지면서 반발이 심하게 일어난다.
3. lone pair > bp(multiple bond) > bp(single bond)으로 다중결합과 단일결합의 차이를 볼 수 있다.
다중결합의 경우에는 더 많은 개수를 갖고 있기 때문에 더 큰 공간을 갖게 되고 반발도 더 커진다.
4. bp( elecropositive substituent) > bp( electronegative substityent)
일렉트로 네거티브한 치환기 쪽으로 전자를 끌고 가니깐 중심 원자 주변 전자가 적어지니 크기도... 반발도 줄어들게 되는 것! 일렉트로 파지티브하면 반대로 끌고 와서 공간도 많이 차지하고 반발도 커진다.
입체수(Steric Number)에 따라서 기하구조를 보여준다. 7일 경우 오각쌍뿔만 안정한 게 아니라 대표적인 거고 캡트옥타히드랄?(모 팔면체), 캣트 트리고날프리즘(모 삼각프리즘)?... 도 있다~ 8도 스퀘어 앤티프리즘(사각 반프리즘)이 있고 위아래 사각형이 45도 엇갈려서(스테그드)되있어서 안티프리즘고 결합 각도는 TaF83-에서만 나온 거라 큰 의미가 없다.
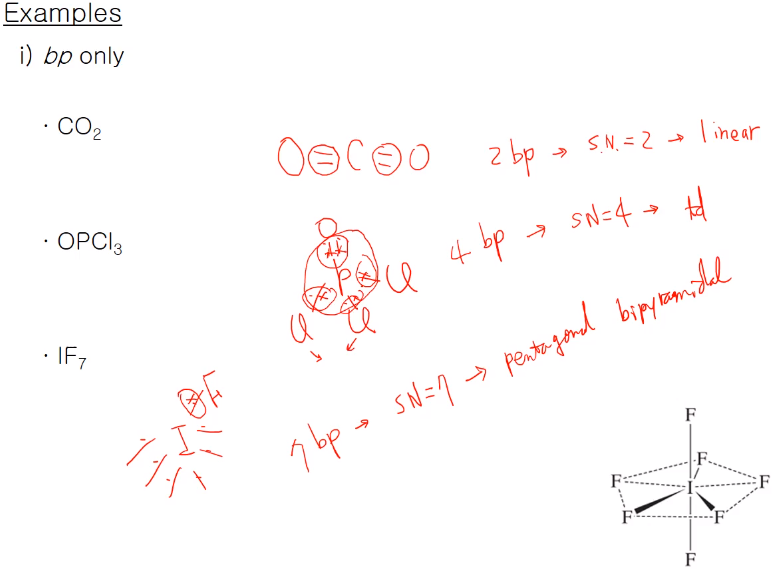
본딩 페어만 있는 경우 기하구조를 예로 볼 것이다.
이산화탄소 C 주위 본딩 페어가 이중결합이지만 VSEPR 이론 경우 본딩 페어가 단일, 이중, 삼중일 경우 구분하지 않고 그대로 한 개로 합니다. 2개의 본딩 페어가 탄소 중심에 있고 steric number는 2가 되고 선형 구조가 됩니다.
포스포릴클로라이드는 중심 원자가 일렉트로 파지티브한 P가 되는 거고 O, Cl3 가 결합되어 있다. P에 다섯 개 전자가 있고 O, Cl한테 전자를 받아 10개를 가지고 있지만 4개의 bp를 갖고 있으므로 steric number는 4로 tetra hedral 기하 구조다, 물론 안전한 테트랄이 아니다. 4개의 치환기가 동일하지 않으며 PO 결합은 이중결합이고 PCl은 단일 결합이므로 이상적인 109.5도 보다 적은 값이 될 것이다.
IF7은 I가 17족 원소로써 주위의 7개의 전자가 있는데 이것들이 7개의 F와 하나의 단일결합을 하면서 주위의 bp가 7개가 있는 것으로 steric number가 7이고 예상 구조가 pentagonal bipyramidal 구조이다. 이런 식으로 어떤 주어진 화학식에 안정한 루이스 구조를 그리고 루이스 구조에서 bp, lp를 구해서 steric number를 구하고, steric number로 가장 안정한 구조는 위 표를 이용해서 기하구조를 정한다. 주의할 것은 VSEPR 이론을 사용할 때 본딩 페어는 단일, 이중, 삼중 결합은 상관없이 하나의 bp라고 생각한다.


다음은 본딩 페어와 론페어 섞인 경우의 예를 볼 것이다.
CH4는 4개의 bp가 있고, NH3는 3개 bp와 1개 lp가 있고, H2O는 2개의 bp와 2개의 lp가 있다. 이 모두 steric number가 4이며 테트랄 구조로 보이며 bp만 있을 경우 여기서 끝나지만 lp도 있어서 다른 기하구조를 보인다. 론페어는 분자구조를 얘기할 때 실제 분자구조에 기여하지 않습니다. NH3 경우는 (삼각)피라미달구조로 론페어를 빼고 N 주위 3개 수소 결합만 갖고 얘기한다. 평면삼각형이 아니고 삼각 피라미드 구조인 건 위의 론페어가 있기 때문에 피라미달이라고 하는 것이다. (론페어를 포함시켜 테트랄이라고 말하지 않는다) H2O도 론페어를 제외하고 수소 bp 2개만 보기 때문에 bent(굽은) 구조이다! 2개인데 리니어가 아닌 bent 론페어 때문!! 109.5, 106.6, 104.5처럼 줄어드는 이유는 론페어 때문!

SF4 분자의 경우 S는 16족 분자로 자기 주변 6개 전자가 있고, F 4개와 단일 결합을 하면서 bp4개 lp 1개의 steric number가 5인 경우다.(tbp)
S 주변 삼각형이 있고 위아래 있는 모양이 있고 equatorial(평형) axial(수직)이 있는데 4개의 본딩과 1개의 론페어가 있는데 론페어가 반발이 더 크기 때문에 가능한 반발이 적은 위치로 가야 합니다. equatorial에서 삼각형 내 결합각은 120도이고 axial은 결합각이 90? 도이다.
결합각이 120도 이상이면 더 이상 전자쌍 간 론페어든 반발이 없다고 생각한다.
그러나 그대로 결합각을 유지하지 못하고 론페어가 좀 더 많은 공간을 차지하려 하니 본딩 페어가 안쪽으로 살짝 굽어들어간 형태로 결합각이 120도 보다 살짝 작다. 론페어는 항상 equatorial 위치에 와야 하고 위와 같이 그림을 그릴 수 있습니다.(axial은 론페어의 반발이 더 많다. 그림에서 2개, 3개 비교!)
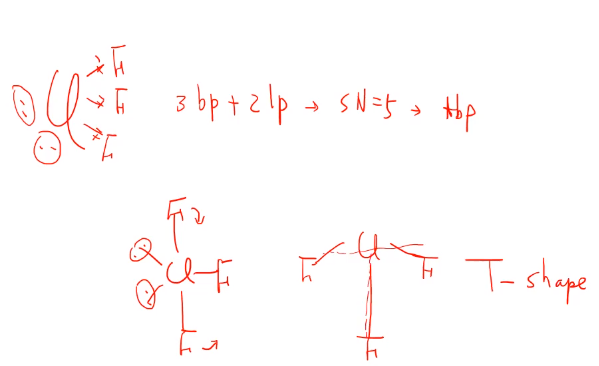

ClF3분자는 Cl과 3개의 F와 단일결합(bp)을 하고 두 개의 론페어가 나타난다. steric number는 5로 tbp 모양이다. lp가 equatorial 위치로 와야 한다! 론페어가 두 개라서? axial에 있는 F 도 안로 굽어 들어간다. 90도 돌려서 보면 T- shape으로 보인다. A는 론페어가 axial 위치 둘 다, B는 하나씩, C는 equatorial에 둘 다 오는 경우고 C가 더 안정함을 알 수 있다.
lp - lp , lp - bp, bp - bp 의 interaction을 비교해 봤을 때 (180도가 되거나 120도 이상은 반발 없다고 무시했을 때)
A의 경우는 lp-bp는 6개의 반발이 있고, 총 6개
B의 경우는 lp-lp 1개, lp -bp 3개, bp - bp 2개로 총 6개
C는 lp - bp 4개, bp -bp가 2개로 총 6개!
숫자는 6개로 같으나 반발의 경우 lp -lp간의 반발이 가장 센데 C에는 없고 B는 하나 있고! B보다 C가 더 안정! A와 C와 비교하면 2개가 bp-bp가 있으므로 C가 더 안정! (bp간의 반발이 가장 작으므로 많을수록 안정하다!)
론페어가 equatorial에 와야 안정하다는 것을 이런 식으로 알 수 있다.

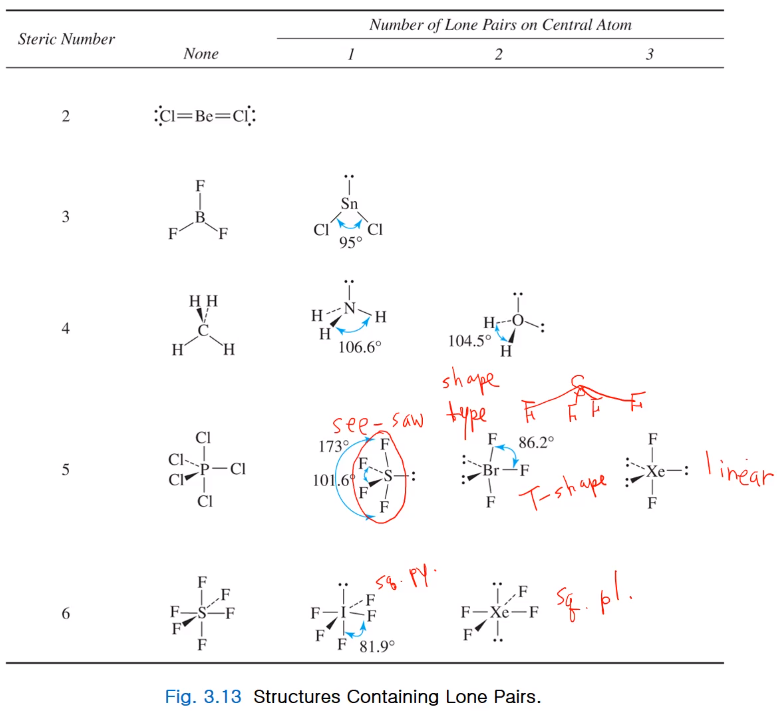
그래서 여러 가지 본딩 페어와 론페어가 있을 때 구조를 모아 표로 만들어 봤다.
sn(steric number) =2 경우 본딩만 있는 경우 선형!
3인 경우 BF3는 삼각형, SnCl2는 벤트!
4경우 메테인 테트라히드랄, NH3 피라미달, H2O는 벤트!
5경우 PCl5는 tbp, SF4 경우 시소,BrF3는 T- shape, XeF2는 선형!
6경우 SF6는 octaheral, IF5는 square pyrimidal, XeF4는 square planar
ICl2-이온과 ICl4-이온 예를 볼 것이다.
1. I가 더 일렉트로 파지티브하니 중심 원자가 될 것이고 I는 17족 원소로써 7개의 전자 중 2개는 Cl과 결합하는데 사용이 된다.
나머지 전자 5개는 페어를 하려 하니 하나가 부족해서 외부에서 하나 받아 1가 음이온이 돼서 결합전자쌍 두 개와 론페어 세 쌍을 만들 수 있습니다.
따라서 sn=5이며 bp-bp인 5에 일반적인 기하구조는 trigonal bipyramidal인데 tbp에서 론페어는 항상 equatorial에 온다.
axial 위치의 본딩 페어 Cl이 와서 위 그림과 같고 linear 구조임을 볼 수 있다.
2. I가 더 일렉트로 파지티브하니 중심 원자가 될 것이고 4개는 Cl과 결합하고 3개로 쌍이 안 되니까 외부에서 전자를 하나 더 받아(이온이 돼서) 론페어 두 쌍을 만들어 bp4개, lp2개를 만든다.
sn=6으로 oh로 예상되지만 론페어가 있으므로 어떻게 해야 하나~~ ?
octahedral에서는 론페어가 반대 방향으로 배치가 되어야 한다! Cl4는 같은 사각 평면에 놓여야 하고 기하구조는 square planar 임을 알 수 있다.
'무기화학' 카테고리의 다른 글
| 무기화학 원자가 결합 이론 [Simple Bonding Theory (Electronegativity)] #9 (0) | 2021.12.09 |
|---|---|
| 무기화학 원자가 결합 이론 [Simple Bonding Theory (VSEPR)] #8 (0) | 2021.12.08 |
| 무기화학 원자가 결합 이론 [Simple Bonding Theory] #6 (0) | 2021.12.05 |
| 무기화학 원자 구조 친화도, 주기 [Atomic Structure (affinity, period)] #5 (0) | 2021.12.03 |
| 무기화학 원자 구조 가리움 [Atomic Structure(shielding)] #4 (0) | 2021.12.02 |


