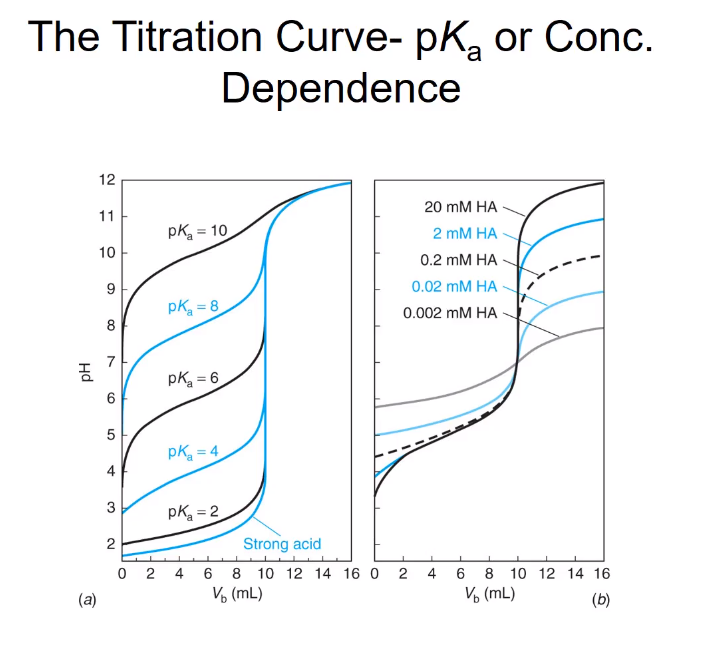
적정곡선의 형태를 이해하는 게 중요하다. 바람직한 적정곡선이 무엇이고 어떻게 얻는지....?
적정곡선은 급변 범위가 넓을수록 좋다. 아무 점을 찍어도 당량점을 예측할 수 있는 근거가 된다. pH미터 값을 읽어 가면서 적정을 하고, 종말점을 4~9라고 생각할 수 있다. 이렇게 예상되는 종말점 범위에서 적정을 멈추고 당량점을 찾는다. pH 4~9 전부 다 Vb= 10mL이다. pKa= 10 곡선을 보면 급변 범위가 거의 없다. 없는 것들은 어떤 pH를 정했을 때 정확한 Vb= 10mL를 찾기 어렵다. pKa= 8도 급변 범위가 있기는 한데 좀... 부족... pKa= 6은 조금 넓으니 pH 8~9 정도에서 멈추면 종말점 Vb= 10mL를 찾을 수 있다. 급변하는 구간이 길면~ pH 관찰하는 데 있어서 당량점을 예측하는데 오류가 줄어든다. 긴 게 유리한데 어떤 요소에 의해 길이가 달라지는가?~ 약산, 약염기의 pKa or b 값, 미지물질의 농도에 따라 달라진다. 약산중에서도 강한 약산의 급변길이가 길어진다. (Ka값은 높고, pKa값은 낮다.) pKa=10으로 제일 약한산은 급변 부위가 매우 부드러워 급변이라기도 그렇다...pKa=10의 약산을 정량할 때는 브로드하게 바뀌는 특징 때문에 적정곡선으로만 종말점을 찾을 수 없다. 그래서 두 번 미분하면 종말점을 정확하게 찾을 수 있다.
농도는 진할수록 급변구간이 길다. 묽어질수록 완만해지고 제일 묽은 농도에서는 거의 급변부가 보이지 않는다. 약염기를 강산으로 정량할 때도 마찬가지다. pKa가 낮은 강염기일수록 농도는 진하면 진할수록 좋다.

이양성자성에서 적정이다. 전수업에서 본 일양성자성의 확장이다. 어렵지 않고 달라진 부분만 캐치하자.
예를 들어 0.1M HCl로 0.100M 이양성자성 약염기 B 를 10.0 mL적정할 때는 적정이 두 단계로 진행된다.
두 단계는 B + H+ → BH+ (첫 번째 당량점)/ BH+ + H+ → BH2+ (당량점)로 진행된다. 첫 번째 폼은 염기성이 강하고, 프로톤을 만나 짝산이 되는 것이다. B(염기)가 100% BH+이 되어야 두 번째 반응이 된다는 게 중요한 포인트다. 다시 말해 B가 다 반응하지 않았는데 중간에 만들어진 BH+가 H+와 반응해서 BH2+ 로 되는 일은 거의 없다.( 한 90% B + H+ → BH+ 이 진행되면 조금 BH+ + H+ → BH2+ 함) 그래서 당량점이 두 개이고, 첫 번째 당량점 부피는 B 가 다 반응할 때까지 들어간 H+ 의 부피이고, 두 번째 당량점은 BH+가 다 반응할 때까지 들어간 H+ 의 부피이다. 당량점은 당연히 변곡점이 나타나는 것으로 알 수 있다.

① 일단 첫 번째, 두 번째 당량점을 계산을 통해 찾는다. 두 번째 당량점은 첫 번째 것의 두 배가 당량점이다.
② B가 H+ 와 0.1mL 반응하면 BH+가 0.1 mL 생성되고, 0.1 mL의 BH+가 100% BH2+ 되기까지 0.1 mL H+ 가 필요하다. 첫 번째 당량점만 계산하면 두 번째 당량점은 쉽게 구할 수 있다.
이미 포인트 두 개(당량점들)을 알고 있고, 적정 시작 전 산 또는 염기의 농도와 첫 번째 당량점 전후, 두 번째 당량점 전후(두 번째 당량점 전은 첫 번째 당량점 후와 겹칠 수 있다. )

③ ⑤ 첫 포인트와 첫 번째 당량점 사이에서, 첫 번째 두 번째 당량점 사이에서 완충 구간이 존재하므로 핸더슨 하셀 바흐식을 쓴다. 첫 번째 완충구간에서 존재하는 삼과 짝염기, 염기와 짝산 관계는 처음 폼에 프로톤 한 개 붙은 폼, 두 번째 완충 구간에서는 프로톤 한 개, 프로톤 두 개 붙은 폼으로 혼합돼서 완충용액을 만든다. 핸더슨 하셀바흐식에서 pKa값은 약산에 해당하는 첫 번째 BH+, 두 번째 BH22+ 의 값을 쓴다.
④ 첫 번째 당량점은 기존에 것과 다르다. 첫 번째 당량점에서 BH+가 100% 만들어진다. 산이면 산 해리 반응하면 되는데 이양성자성인 BH+는 양쪽성인 중간체(아미노산에서는 쯔비터이온)고려해야한다. pH를 구할 때는 평형의 체계적인 처리를 통해 복잡하게 구한다. 농도가 만약 높다면 1/2(pK1+pK2)로 구했다. 이런 점을 잘 모르면 BH+을 보고 약산이니까 약산해리반응 Ka=x2/F-x 이므로 x는 '몇~' 거기에 -log 씌어서 pH를 구하는데 이러면 오답이다.
산, 염기 두 가지 반응 다 써놓고 평형의 체계적인 처리를 통해 pH를 구해야 한다.
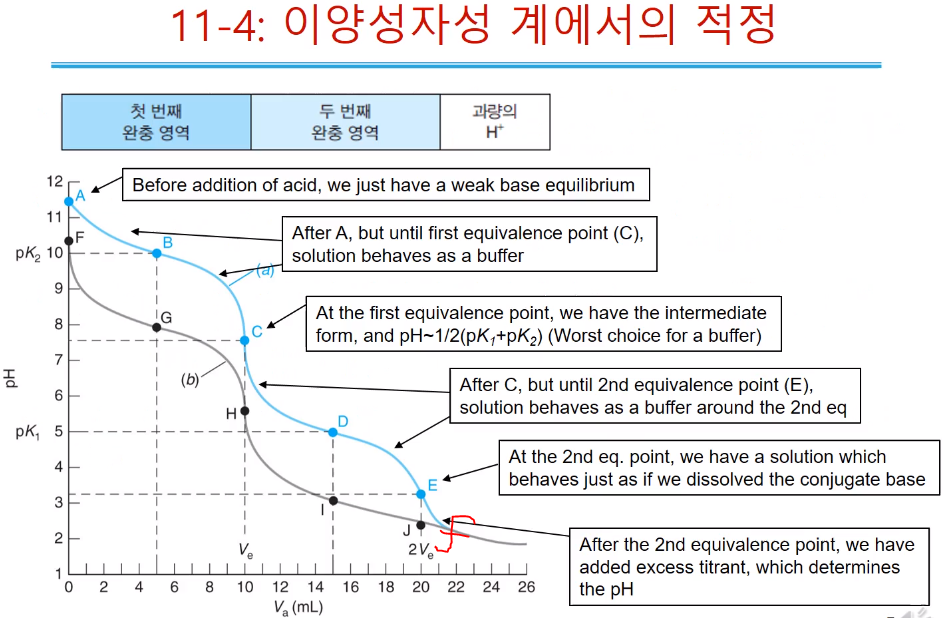
이 양성자성 염기를 강산으로 적정한 곡선이다. 처음 연기성 용액이므로 pH 값이 크다. 처음 알아야 할 것은 당량점 두 개(C, E)를 알아야 한다. 일양성자성과 달리 두 개의 당량점과 두 곳의 느슨한 점 두 곳이 있다.
ⓐ 적정 전 pH는 이양성자성 산염기에서 강한 산or염을 녹였을 때 일양성자성 pH구할 때처럼 한다. 두 번째 반응에서 생기는 프로톤과, 수산화이온는 전체 pH에 영향 안준다.(왜냐면 한번 프로톤을 내놓으면 두 번째 프로톤 잘 안내놓음) 그래서 첫 번째 산 해리, 염기 가수분해 반응이 전체 pH를 지배한다.
ⓑⓓ 완충구간으로 핸더슨 하셀 바흐식으로 구한다.
ⓒ 첫 번째 당량점은 중간체가 만들어지는 것이므로 pH는 평형의 체계적 처리나 농도가 높을 때 1/2(pK1 + pK2)로 근사하고,
ⓔ 두 번째 당량점에서는 ⓒ에서 생긴 짝산(BH22+)의 산해리 반응에 대해 pH를 구한다.
ⓕ 당량점 이후 과량의 프로톤이 남아있으므로 프로톤 농도(전체 넣어준 양 - 반응한 양) x 묽힘 인자로 pH를 구한다.
정리!
전체적인 패턴은 일양성자성 산의 적정곡선과 비슷한데 당량점이 두 번, 삼양성자성이면 당량점이 세 개이다.
여기서 첫 번째 당량점은 중간체의 폼이기 때문의 pH=1/2(pK1 + pK2)로 구한다.(삼양성자성 일 경우 두 번째 당량까지, 즉 마지막 당량점은 양쪽성이 아니므로 근사하는 식을 사용할 수 없다.)

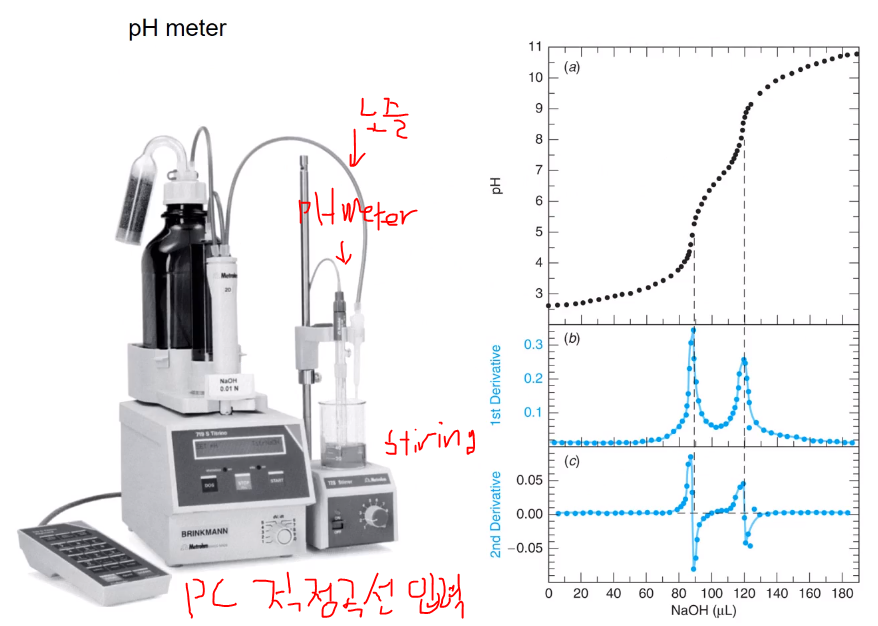
앞에서 본 것들이 실험적으로 종말점 검출 시 pH 미터를 사용했다. pH를 꼽고 뷰렛으로 적정액을 가하면서 pH 변화를 본다. pH 변화가 급하게 일어나는 부분이 종말점이다. 이런 실험을 수동적으로 손으로 할 수 있지만 자동 적정기(autotitrator)가 있다. 자동적정기는 1초에 몇 방울 넣고, pH 기록 등 세팅 값에 따라 적정되고 곡선의 급변 범위를 찾을 수 있다. 급변 범위가 미미한 pK가 작거나, 농도가 낮은 경우, 분석 물질의 특징이 있을 때 프로그램에서 미분해서 종말점을 찾는다.
우측 그림은 자동 적정기 모습이고, 노즐로부터 titrant가 떨어지고 밑에서 스터링하고 pc에 적정곡선이 입력되고 종말점을 쉽게 찾을 수 있다. (a) 의 경우 급변 범위가 느슨하므로 미분을 통해 (b, c)처럼 변곡점을 찾을 수 있다. 1차 미분하면 최대점이 되고 최대점도 명확하지 않다면 한 번 더 미분해서 플러스에서 마이너스 급격히 변하는 y축이 0이 되는 곳의 x축 값이 종말점이 된다. 현대에서는 자동 적정기를 쓰며 실험에서 배운 적정은 러프하게 초기 실험할 때 쓴다. 적정에서 기본이기 때문에 실험을 통해 공부했고, 이론적으로도 적정곡선을 알아야지 실험 실패 시 개선 능력이 생긴다. 실제로 실험하다 보면 (a)처럼 명확하지 않는 경우가 많고 미분해도 오차가 있을 수 있다. 분석 물질의 농도가 묽은 경우 농축시키거나 다른 방법을 통해 급변하는 구간이 명확히 나타나게 해서 종말점을 찾는다.

지시약의 변색 범위와 적정곡선의 종말점 당량점의 관계로 검출한다. 급변 범위 안에 지시약의 변색범위가 들어가는지 보는 것이다. 지시약들이 적당하게 활용되면 나름 정확한 종말점을 검출하고 당량점을 예측할 수 있다. 침전, 산염기, 착물 적정마다 지시약이 다르다.
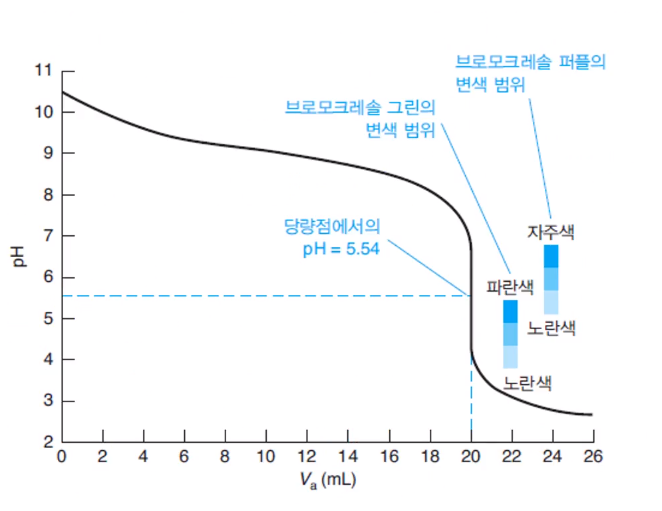
지시약 통해서 종말점을 얻으면 위와 같은 적정곡선을 그릴 수 없다. 실험을 통해 몇 가지 지시약 후보를 가지고 실험을 해야 하므로 어렵고,,, 급변 범위가 알려진 것들은 적당한 지시약을 쓰면 되는데 이런 경우가 아니면 어렵다. 만약 pH미터로 측정하고 지시약 적용하는 것은 쉽다. 근데 굳이 pH 구해서 적정곡선 그렸는데 지시약을?
그러니 지시약은 pH미터가 없고 어떤 산의 종류를 알고 급변 부분을 아는 경우 사용해서 종말점을 검출한다.

산염기 적정 때 일단 표준용액을 만들어야 한다. 만드는 방법 중 제일 좋은 것은 일차 표준 물질을 가지고 만들고자 하는 표준용액을 표준화 시킨다. 일차표준물질, 표준화 등 정의를 정확히 알고 있어야 한다.
NaOH, KOH등 OH붙은 것들은 물을 흡수하기 때문에 사용할 수 없다. 하지만 표준 용액으로 활용할 때는 표준화를 해야 한다. 염기성 경우 CO2흡수 및 유리병 녹인다. 그 외에 적정할 때 다양한 주의점이 있다. 사용하는 분석 대상이 되는 산,염기와 적정용액이 되는 산염기 및 지시약의 특징을 알고 주의해서 정확하게 계통 오차를 줄여서 종말점을 검출하고 당량점을 예측해야 한다.

평준화 효과: 두 개가 동등해지는 효과! 산 세기: 산해리에 대한 평형상수는 HClO4>HCl 이다. 하지만 물속에 들어가면 해리해서 하이드로늄이온을 만든다. HClO4>HCl 이지만 둘 다 100% 해리돼서 미칠 수 있는 세기의 정도는 크게 차이 없다. 예를 들어 HClO4가 분해되면 프로톤이 나오고 물과 만나서 H3O+를 만든다. HClO4,HCl는 거의 100% 쪼개져서 남은 게 없으므로 실제 산 역할 할 수 있는 것은 H3O+밖에 없다. NaOH, KOH도 평형상수 차이가나지만 100% 쪼개지고 염기 역할 할 수 있는 것도 수산화이온 등 마찬가지다. 즉, 평준화 효과는 HClO4>HCl 이렇게 차이나도 물속에서는 각각 해리해서 하이드로늄만 남기 때문에 하이드로늄 이온 하나로 존재한다. 원래 있던 산들은 분해되서 사라지므로 하이드로늄이온이 제일 강한 산이 된다. HClO4> HCl차이지만 물속에 녹이면 산의 세기는HClO4=HCl이다. 즉, 두 산은 하이드로늄 이온으로 평준화됐다. 만약 물이 아닌 아세트산 용매에 녹이면 둘 다 약산으로 변한다. HClO4(10-5) > HCl(10-9) 으로 되기 때문에 HClO4가 만 배 더 크다. 이 경우는 일단 약산으로 역할하기 때문에 프로톤을 내놓고 나서도 HClO4, HCl이 많이 남아있다. 음이온인 HClO4, HCl이 들어있으니까.... 약산으로 존재한다는 것은 HClO4 는 1000개 중 한 개만 프로톤 내놓는? HCl 천만 개 중 프로톤 한 개 내놓는다. 약산에서는 산의 세기가 HClO4 >> HCl이다. 또, HClO4, HCl는 그대로 남아있으니 하이드로늄이온을 내놓는다 하더라도 HClO4>HCl 관계처럼 산의 세기가 차이 난다.
'분석화학' 카테고리의 다른 글
| 분석화학 EDTA(산염기, 착물) #46 (0) | 2021.11.07 |
|---|---|
| 분석화학 EDTA #45 (0) | 2021.11.06 |
| 분석화학 산-염기 적정 (조건 별 적정곡선) #43 (0) | 2021.11.04 |
| 분석화학 다양성자성 산-염기 평형(등이온점, 등전점) #42 (0) | 2021.11.03 |
| 분석화학 다양성자성 산-염기 평형(완충 pH계산, 주화학종 판별) #41 (0) | 2021.11.02 |