EDTA를 이용한 금속이온을 정량하는 적정 법이다. EDTA를 이용하기 때문에 EDTA 적정법이라기도 한다. EDTA랑 금속이랑 착물을 형성하기 때문에 착화합물이라고도 한다. 착화법이라기도하고... 다양하게 이름을 불린다.

먼저 EDTA가 킬레이트라는 물질 중 하나이다. EDTA가 뭔지, 적정 곡선 그리는 법, 적정하기 위한 보조 착화제, 산염기 지시약처럼 지시약이 있다. EDTA 적정 방법들도 있다.

EDTA는 에틸렌다이아민테트라아세트산의 약자이다. 금속 이온 1개 EDTA 1 분자 EDTA가 금속이온을 배위해서 안정한 착물을 형성한다. 착물을 주로 금속이온과 EDTA처럼 배위하는 분자들이 결합하여 만들어진 화합물을 얘기한다. 1:1 정량적으로 반응하기 때문에, 두 개 간의 반응이 매우 큰 평형상수를 가져 정량분석에 유용하다. 다양한 적정 반응은 평형상수가 클수록 정량(적정)에 있어서 오차가 줄어든다. 1:1 , 평형상수 큰 것이 EDTA 적정이 유용한 이유가 된다.
식품, 세제, 세척 시약 등 EDTA가 금속을 잡아줘서 금속이온이 역할 못하게 한다. 센물(칼슘 마그네슘 등 이가 이온들이 물을 미끌미끌; 우물물, 약수물..)은 금속 때문에 특징이 생기는데 EDTA를 넣어주면 물 자체 성질을 바꿀 수 있다. EDTA는 인체에서 독극물이다. 신체 내에는 금속이온들이 다양한 대사 활동에 참여한다. EDTA를 섭취하면 그런 금속이온 배위를해서 착물 만드는 제 역할을 할 수 없게 하므로 신진대사에 어려움을 줘서 많이 먹으면 죽는다. 소량의 첨가물들은 세제, 세척 용도로 첨가제로 활용된다.

EDTA와 같은 물질을 킬레이트라고 한다. 금속 이온은 주로 전자쌍을 주는 리간드와 잘 결합한다. (루이스산염기에서 비공유전자쌍을 주는 것은 염기, 받는 것은 산) 금속은 비어있는 오비탈이 있어서 리간드에 비공유 전자쌍이 결합할 수 다. 그래서 금속은 루이스 산, 달라붙는 리간드는 루이스 염기로 작용한다. 금속이온이 결합할 때 금속이온을 한군데에만 결합한(배위수 한자리부터 ~아홉 자리까지 리간드가 배위할 수 있다.) 한자리 리간드(Monodentate dent가 치아 접두사?? 문다는 뜻 ex CN-)는 한자리만 문다. (AgCl 중 CN이 리간드 역할을 해서 결합!) 두 자리 리간드는 에틸렌다이아민이 대표적이다. 나이트로젠이 비공유 전자 한쌍이 금속의 빈 오비탈에 들어가 두 자리 배위(두 자리 리간드)라고 한다. 두 자리 이상의 리간드를 여러 자리 리간드 또는 킬레이트(chelating; 물다.) 리간드 라고 한다. 킬레이션, 킬레이팅, 킬레이터 등 알고 있어야 한다.

킬레이트 효과라는 것은 구리가 두 자리 리간드와 결합하고 있다.(착물 형성) 여기에다가 더 큰 배위수 할 수 있는 리간드(셋~ 다섯 자리 리간드)를 넣으면 기준 두 자리 리간드는 떨어지고 더 높은 배위할 수 있는 리간드가 붙게 된다. 모든 반응은 더 안정한 물질이 만들어지는 방향으로 간다. 결국 반응이 진행되었을 때, 두 자리 vs 여섯 자리 반응물 중 더 큰 배위수인 여섯 자리 리간드와 결합한다. 고로 리간드의 자리와 평형상수는 비례한다. 정반응 역반응 갔다가하면서 유리한 방향으로 평형 이루듯 여기저기 붙으면서 더 안정한 쪽으로 간다.

Cd(H2O)62+ 라는 착물이 있다. 물은 한자리 리간드이기 때문에 상당히 약하게 배위한다. 여기에 엔틸렌다이아민 두 분자가 반응하면, 두 자리 리간드이므로 4자리 차지하니 물 4개가 떨어진다. 에틸렌다이아민 대신 메틸아민 쓴다면? 메틸아민은 한자리 리간드이기 때문에 같은 네 자리 차지하려면 분자 네 개가 반응해야 한다. 에틸렌다이아민 두 분자가 메틸아민 네 분자 반응보다 우세하다. 에틸렌다이아민 두 분자와 반응한 게 더 안정! (반응이 우세, 반응100%, 평형상수가 크다. 반응물 안정 등이 무슨 뜻인지 이해해야함!)

여기서는 네 자리 리간드인 아데노신 삼인산을 소개한다. 2가 양이온들과 결합할 때 금속 이온들은 총 6개의 배위(자리)가 있으므로 네 자리 리간드, 나머지 두 자리는 물 분자가 차지한다.
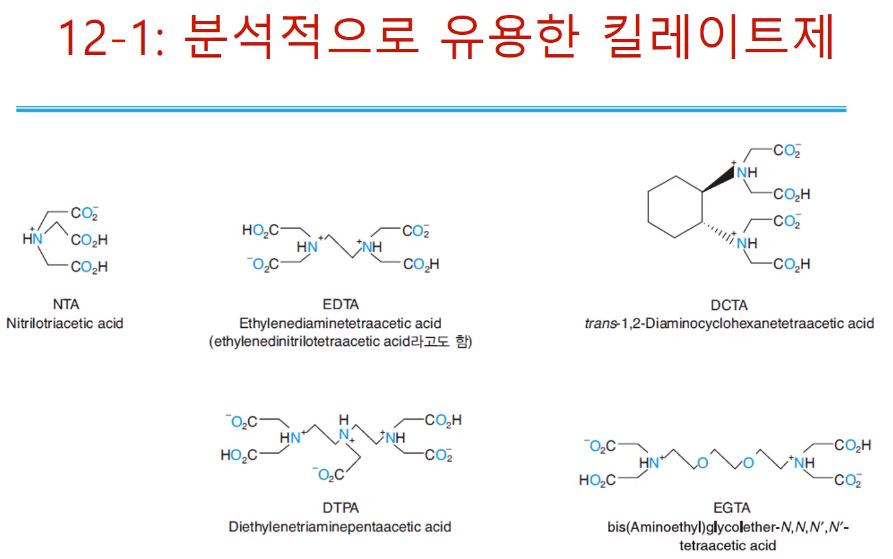
분석적으로 유용한 킬레이트제로는 위와 같이 있다. 일단은 EDTA만 알아도 되고, EDTA구조를 보면 가운데 양쪽 아민까지는 에틸렌 다이 아민이고, 여기에 각각 프로톤이 하나씩 떨어지고 아세트산 그룹이 네 개가 붙어있다. 차지를 가질 수 있는 그룹이 총 6개이다. (O에 - 4개 N에 +2개 )
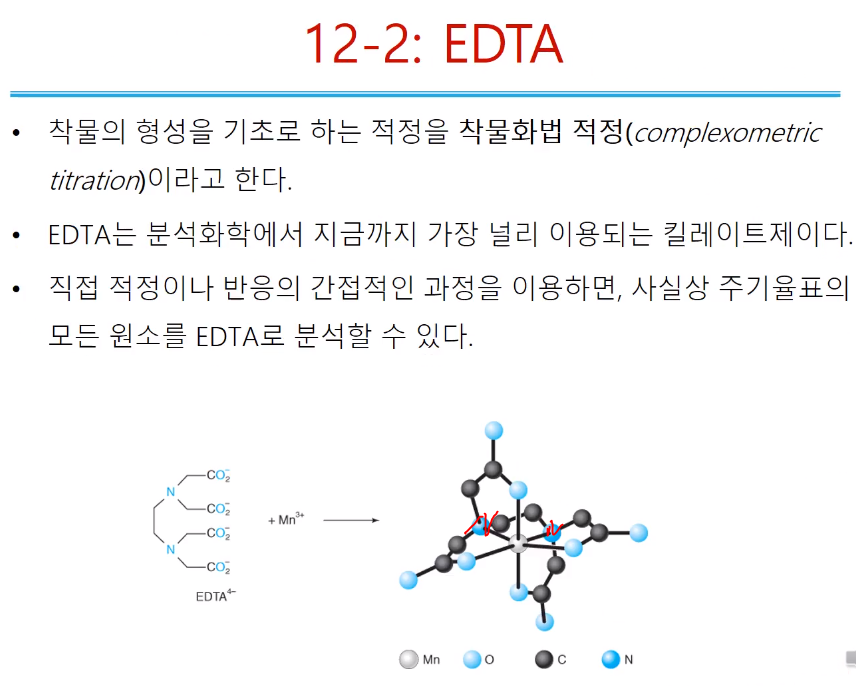
착물화법 적정은 착물의 형성을 기초로 하는 적정! 아까는 EDTA 적정이라고 했는데,,, 다양하게 부를 수 있다. 영어의 공식 명칭은 complexometric titration 이다. EDTA는 금속정량시 유명한 물질로 분석화학 시 널리 이용되는 킬레이트이다. 직접, 간접, 역 적정 등 활용하면 주기율표 모든 금속 원소를 EDTA분석 가능하다. 물론 금속 아닌 것들도 간접 방법으로 분석할 수 있다. EDTA는 위처럼 프로톤 다 떨어진 상태로( EDTA4-; 음전하 4개) 그릴 수 있고, 다양하게 그릴 수 있다. Mn3+와 1:1 반응하면 망간이 중심에 있고, 질소 두 개, 산소 네 개가 결합되어 있다.
배위수 6이므로 기본적인 구조는 정 육면체인데, 손으로 공 잡는 것처럼 한쪽 방향으로 공 잡는데 EDTA도 마찬가지로 이상적인 정 육면체를 갖지 못하고 찌그러진다.
'분석화학' 카테고리의 다른 글
| 분석화학 EDTA(조건형성상수) #47 (1) | 2021.11.08 |
|---|---|
| 분석화학 EDTA(산염기, 착물) #46 (0) | 2021.11.07 |
| 분석화학 산-염기 적정 (다양한 종말점 검출) #44 (0) | 2021.11.05 |
| 분석화학 산-염기 적정 (조건 별 적정곡선) #43 (0) | 2021.11.04 |
| 분석화학 다양성자성 산-염기 평형(등이온점, 등전점) #42 (0) | 2021.11.03 |