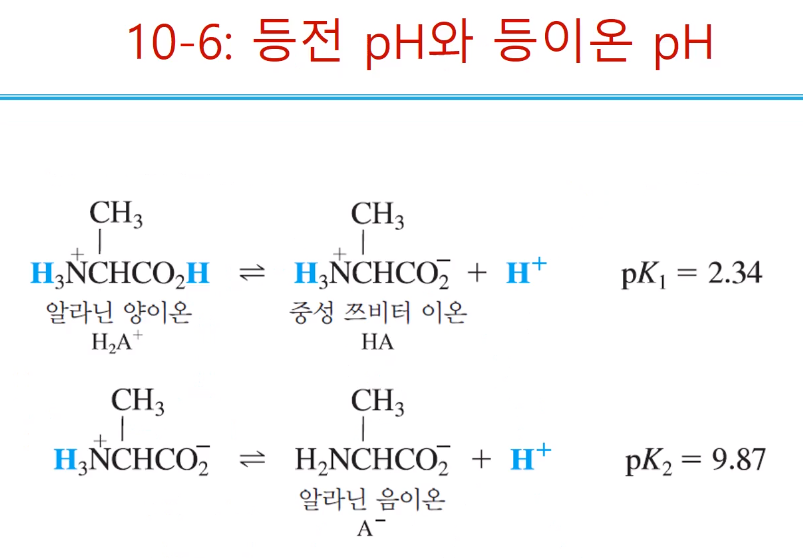
등전 pH와 등이온 pH다. 산염기가 녹아있는 용액의 성질을 나타내는 용어이다. 단백질이나 아미노산과 같은 전하를 많이 가지고 있는 물질들의 용액의 성질을 이야기할 때 자주 등장한다. 위에서는 단백질보다 간단한 아미노산에 대해 얘기한다. 아미노산의 종류인 알라닌 이 산성에서 존재할 때는 H2A+가 되고 알라닌 중간 형태는 '+, -'를 둘 다 가지고 있어서 중성이 되는 것이다.

일반적으로 등이온점[등이온 pH(점=pH)]라는 것은 용액이 있을 대 그 안에 어떤 물질을 녹여서 이온이 녹아있는 그런 용액을 만든다. 그럴 때 pH를 측정한다. 순수한 물에다 순수한 다양성자성 산을 녹일 때 만들어지는 pH를 등이온점이라고한다. HA는 양전하 음전하가 하나씩 있어 중성이 되는 쯔비터이온이다. HA를 순수한 물에 녹였을 때 어떤 반응을 통해 pH를 나타내는데 이게 등이온 pH이다. 물에 들어가면 양쪽성이라 산, 염기로 작용한다. 산으로 작용하면 A-, H+를 염기로 작용하면 H2A+, OH-를 만들어낸다. 약한산 약한 염기이기 때문에 대부분 HA 형태로 존재한다. 그렇지만 산으로 존재할 때 염기로 존재할 때 그때 정도는, 반응에 대한 평형상수는 H+, OH-의 농도와 H2A+, A-의 농도는 같지 않을 수 있다. H+, OH-가 같으면 ±0이면 pH 변화는 없으므로 물의 pH=7이 되는 것이다. 그러나 만들어지는 비율이 다르기 때문에 pH는 7로부터 벗어난다. 이럴 때 pH는 HA(중간체)가 물에 녹았을 때 pH를 구하는 방법과 똑같이 평형의 체계적 처리를 통해 구한다.(위 노란 박스)
일단 등이온pH를 이해하고, 양쪽성화학종(HA)이 물에 녹았을 때 나타내는 pH와 같다는 것을 알아야 하고 그 pH는 평형의 체계적인 처리로 구할 수 있다. 이해하고 잘 기억해야 한다.
[A-]가 [H2A+]보다 클 것이라고 했다. 값을 구해보면 pH가 6.11(책에 값있음)정도 나오니까 6은 7보다 작으므로 H+가 많이 만들어졌으므로 H2A보다 A-가 많이 만들어졌음을 알 수 있다. 책에 이 이유가 자세히 있다. 중성의 물질이(HA) 산이으로 작용하면 A-가 염이로 작용하면 H2A가 만들어진다. A-가 더 많이 만들어졌다는 것은 pKa에 해당하는 산해리반응이 염기가수분해반응보다 더 많은 비율로 반응했다는 것이다. 즉 산을 많느는 반응이 더 활발하다 평형상수가 더 크다로 표현할 수 있는데 Ka, Kb의 평형상수를 비교하는 것은 헷갈리니까.... H+가 많이 만들어졌으니 A-도 많이 만들어진다.A-H+는 같이 움직인다. 지금 pH를 얼마인지 아는 상태에서 얘기하는 것이다. pH가 6.11이 나오는데 수산화이온보다 프로톤이 더 많이 만들어졌기 때문이다.
어떤 물질의 중성의 쯔비터 이온을 넣고 pH를 측정했더니 7보다 작은 값이 나왔다. H2A, A-중 어느 게 더 많은지 예측할 수 있다. 등이온점을 알면 직접 녹여 pH를 측정 않안해도 H2A, A-중 뭐가 더 많이 만들어지는지 생각하고 용액에 녹아있는 주 화학종을 알 수 있다. 이러한 이유로 등이온점이 중요하다

등전점(등전 pH)과 등이온점이 헷갈린다. 구별해서 기억해...
다양성자성 산을 녹였을 때 그 용액 속에 들어있는 이온들의 평균 전하가 0일 때의 pH다! (위 슬라이드에서는 다양성자성산의 평균전하가0이라고 표현했는데 더 정확한 표현은 녹아있는 이온들의 전하 평균 전하가 0인것이다.), 중성의 HA를 녹일 때 생기는 4가지(H2A-,A-, H+,OH-) 이온이 생기는데 , 그것들의 전하의 합이 0이라는 것이다. 0이 되려면 +, -전하가 같은 의미인 H2A-=A- 라는 뜻이다. (H2A-,A-, H+,OH-관계로 보면 H2A-(H+)=A- (OH-), 처럼 된다.) H2A-=A- 으로 농도가 같아지는 점이 등전점이다. 개수, 몰 등 양으로 얘기할 수 있지만 전하량(차지밸런스 처럼)으로도 말할 수 있다. [H2A+]1+를 갖는 전하의 개수와 [A-]1-를 가진 전하의 개수가 같으면, 개수도 갖지만 전하도 같아진다. 숫자는 같은데 +. -가 다르기 때문에 둘을 더하면 전기적으로 0이 된다. ??? (잘 이해 안 됨..) 그래서 iso electric이란게 전기적인 성질이 중성이 되는 곳이 등전점이다.
알라닌에서 등이온점은 순수한 중성[HA]을 녹였을 때 생기는 등이온 pH였고, 그때 [A-] 많았다. [H2A-]=[A- ] 이렇게 만들어주려면 강산 or 강염기중 뭐를 넣어줘야 하는가? 당연히 강산을 넣어야 [A- ]가 [H2A-]로 바뀌고 [H2A-]=[A- ]이 되는 점이있을 것이다. 그때까지 강산을 넣고 pH를 측정하면 그때가 등전pH이다. 단순한 실험으로 [H2A-]=[A- ]를 구하긴 어렵고 계산을 통해서 [H2A-]=[A- ]되는 지점을 찾아야 한다. 평형의 체계적인 처리로 계산할 때 [H2A-]=[A- ] 라고 가정하고 식을 넣으면 그때 pH는 pH=1/2(pKa1 + pKa2)이된다. 이 식은 평형의 체계적인 처리를 통해서 HA가 녹아있는 pH를 구할 때 F(형식농도)값이 큰 경우 나타났던 식이다. 우연히 같아진 것이지 접근 방법은 완전 다른 것을 이해해야 한다.
단백질은 아미노산의 고분자이므로 중심에는 물을 싫어하는 하이드로포빅한 부분이 있고 바깥은 하이드로 필릭하다.아미노산 중에서도 전하를 갖는 치환기도 있을 텐데 주로 그런 것들이 밖에 있다. 밖에 있는 작용기들은 전하를 많이 띠는 것이 많고 +, -가 섞여있다. 그런 단백질을 물에 녹여 바깥에 있는 전하의 조절을 하는데 pH를 바꿔가며 조절하면 아미노산 바깥의 양전하와 음전하의 수가 같은 pH가 얻어질 수 있다. 그 pH를 몇인지 알게 되면 우리가 다르게는 주변의 pH를 단백질을 물에 녹여 임의로 산염기 넣으며 조절 가능하고, 그렇게 용액의 물성을 산성이나 염기성으로 가져가면 등전점보다 크거나 작은 pH값을 갖을 수 있다. 등전점보다 높은 pH값을 갖게 해주면 [H2A-]=[A- ]에서 프로톤을 더 내놓는 음전하[A-]를 더 많이 존재한다. 단백질 표면이 처음 등전점이니까 [H2A-]=[A- ]으로 토탈 전하량은 0인데 주변 pH가 커지면 표면에 있는 작용기들이 프로톤을 내놓고 단백질 표면은 음전하가된다. 반대로 pH낮추면 양전하를 갖게 되고, 이뜻은 단백질 표면의 전하를 조절할 수 있다는 것이고 단백질의 표면 전하를 양이나 음으로 만들면 단백질 분리할 때 유용하게 사용할 수 있다. 전기를 걸어서 전기장을 만들고 그 안에 단백질을 두면 전기장을 따라 전하를 띤 단백질이 움직인다(중성이면 안움직임). pH를 조절하면 단백질은 전기장 내에서 움직이게 할 수 있고, 움직일 때 단백질들이 가지고 있는 표면 전하량, 단백질의 크기에 따라 움직이는 속도가 다르다. 여러 종류의 단백질이 섞여있을 때 pH를 조절하게 되면 단백질을 분리할 수 있다. 이렇게 등전점을 활용할 수 있다 책 보충 10-4 를 보면 등전점 설명이 있다.
'분석화학' 카테고리의 다른 글
| 분석화학 산-염기 적정 (다양한 종말점 검출) #44 (0) | 2021.11.05 |
|---|---|
| 분석화학 산-염기 적정 (조건 별 적정곡선) #43 (0) | 2021.11.04 |
| 분석화학 다양성자성 산-염기 평형(완충 pH계산, 주화학종 판별) #41 (0) | 2021.11.02 |
| 분석화학 다양성자성 산-염기 평형(아미노산 루신) #40 (0) | 2021.11.01 |
| 분석화학 다양성자성 산-염기 평형(아미노산 루신) #39 (0) | 2021.10.31 |