Ch. 2 Atomic Structure#1
일반 & 물리화학에서 배워온 내용인데 무기에서 복습하고 배우는 데에는
무기 화합물들이 존재하는 거의 모든 원소에 대해서 다루고 있고 이 원소들의 원자 내 전자들이 어떻게 분포해 있는지 알아야 원소 원자들이 어떻게 결합하고 어떤 성질을 갖고 있는지 알 수 있음.
<Quantum Numbers & Atomic Wave Functions>
원자 구조라고 하지만 실제로 원자 내 대부분은 전자가 차지하고 있고 따라서 전자가 원자 내 어떻게 분포해 있는 게
원자구조가 어떻게 이루어져 있나 얘기하는 것이라 할 수 있다.
원자 내 전자들은 파동함수라는 것으로 제한되어서 운동하고 있다.
파동함수는 양자 수로 구분 될 수 있다.
양자수는 서로 다른 4개의 양자수가 있다. n, l, ml, ms

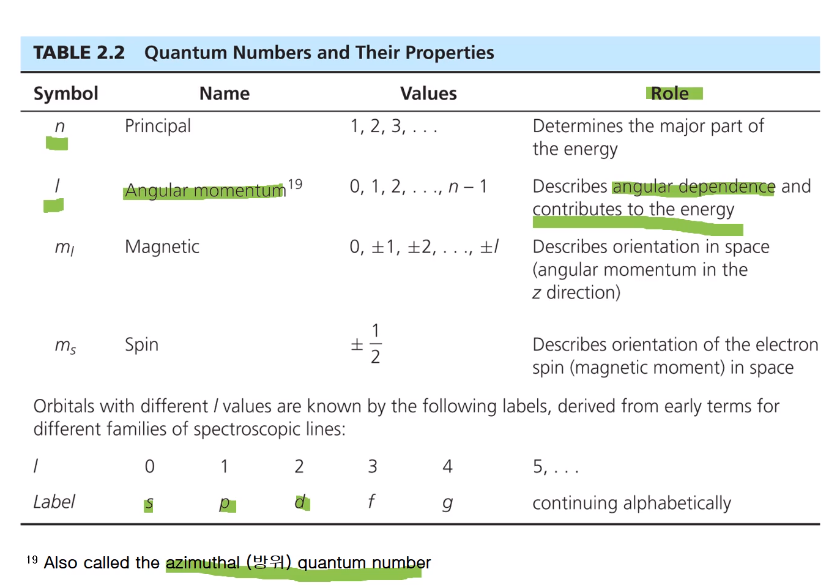

4개의 양자수는 서로 조합이 되어 있어서 특정한 n 값에서 가능한 l, m 값이 제한되어 있다.

전자는 랜덤 모션이 아니라 제약된 운동을 하는데 파동함수로 표현된다.
x, y, z 변수로 나타내지만 구형 좌표로 나타낸다.
spherical coordinates는 r, theta, pi로 이루어져 있다.
파동함수는 세 가지 변수는 거리와 두 개의 각으로 나타낸 것을 방사 파동 함수와 각 파동함수로 나타낸다.
원점은 핵이 되고 일정한 거리에 어떻게 분포하는지 Radial wave function과 어떤 모양, 방향으로 분포해 있는 건 각 파동함수에 의해 정해진다.
일정한 거리에서 발견된 확률 함수는 " 4 πr2 R2 "으로 표현한다.
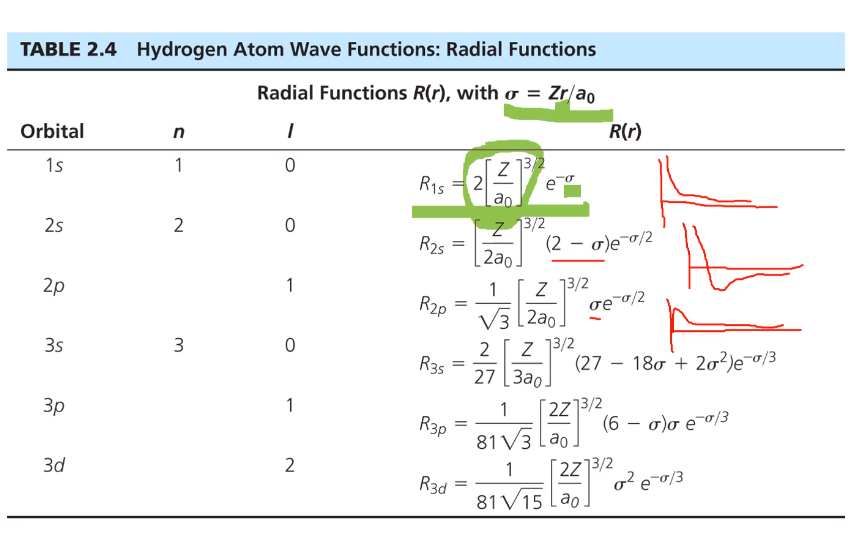
- 이 표는 가장 간단한 수소 원자의 Radial Functions을 보여준다.
- 1s에 뉴클레 차지로써 Z와 a0은 상수이므로 변수는 sigma 밖에 없다. 또 sigma는 Zr/a0이니 r 값만 변수가 된다.
가로축은 r이고 세로축은 Radial functions이라고 했을 때 위 그림과 같다.
- 2s에 sigma가 2가 되면 0이 되어야 지만 e-시그마에 해당하는 함수이기 때문에 그래프를 그리자면 위와 같다.
- 2p 경우 sigma가 0일 때 radial wave functions이 0이지만 e가 유지되니까 그래프를 그리자면 위와 같다.
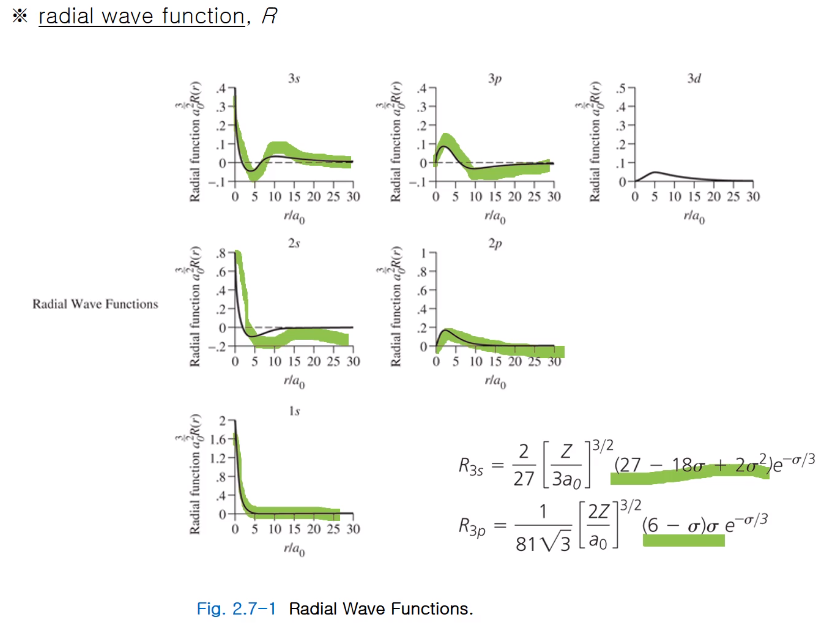
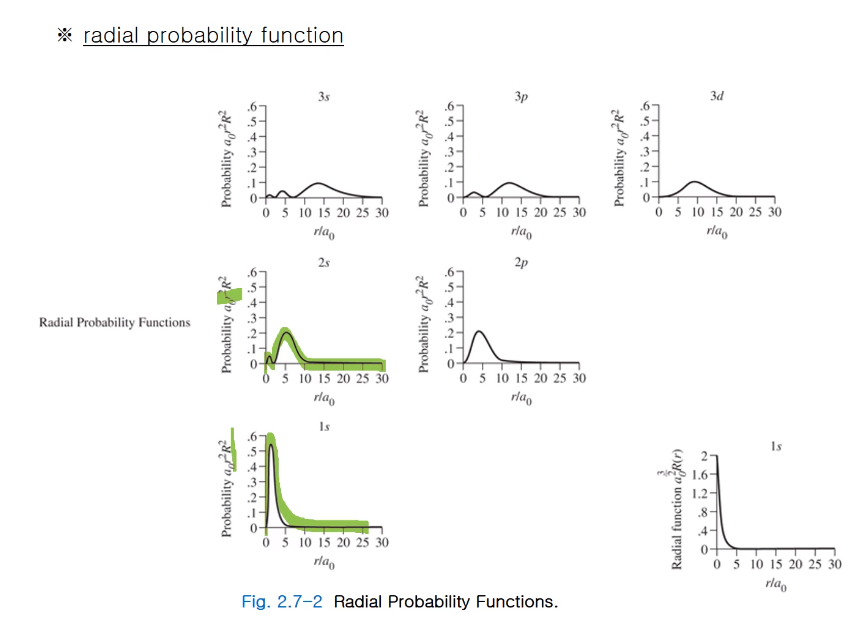
방사 방향 파동함수로부터 방사 방향 확률함수가 얻어지는데 세로축이 바뀌었다.
파동은 r 값이 0이 되면 무한대가 되지만 확률함수는 r 값이 0이 되면 0이 된다.
실제로 0에서는 원자 핵이 있기에 전자를 발견할 확률이 없다.

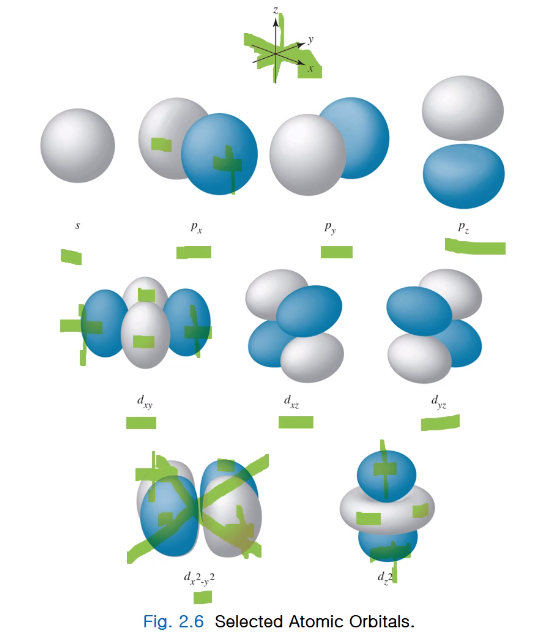
angular wave function을 보겠습니다.
theta와 pie로 정의되는 함수로서 l, m 값에 따라 서로 다른 파동함수로 나타난다.
- l이 0일 때 theta와 pie 는 값을 갖고 있지 않아서 상숫값으로 나타낸다.
이걸 만일 x, y, z로 해도 상숫값으로 만 얻어지고 다른 변수가 없기에 원형의 모양으로 나타내게 됩니다.
- l이 1일 경우 서로 다른 3개의 m, l이 있고 theta, pie 값은 각 있으며 모양이 있고 원형으로 나타내면 아령 모양으로 있다.
- l 값이 2일 경우 서로 다른 5가지가 있는데 이들의 각각 theta와 pie는 위 표와 같은 값이 있다.
- 다시 오비탈의 3차원 면적을 볼 수 있는데 파란 구가 플러스면 하얀 구는 마이너스이다.(dx2-y2, dz2) 부호가 잘 못 되었다.
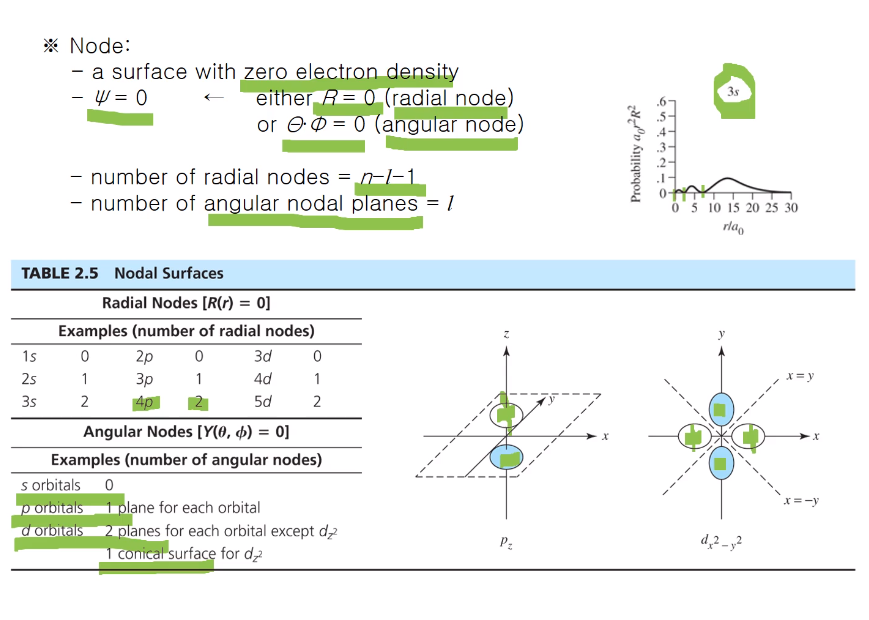
전자가 분포해 있는데 분포해 있는 패턴이 핵으로부터 어느 정도 거리에 분포해 있는지 radial wave로 나타낸다.
어떤 모양은 angular wave로 나타낸다.
wave 가 0 이 되는 부분을 node(마디)라고 한고, 방사, 각 마디가 존재한다.
0점은 노드가 아니다. 핵으로부터 일정한 거리가 있는 곳이 노드이다. 3s 경우 위와 같이 2개가 된다.
방사 노드의 공식은 위와 같이 n -l -1이고 각 노드는 l이다.
등배를 이루는 각 구 사이의 두 개의 면이 있는 이 함수를 지나는 선을 따라서 위에서부터 아래로 가로지르는 이 면을 노달 surface라고 한다.
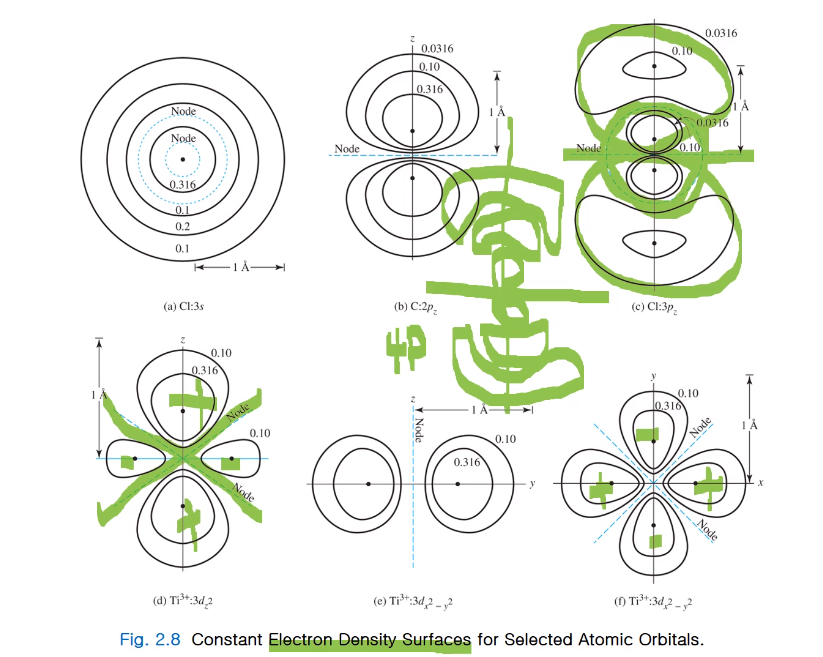
전자 밀도 표면 or 전자 밀도 지도 라고 표현하는데 등고선처럼 나타낸다.
-전자를 발견할 확률이 0.1, 0.2, 0.316인 선을 전자 밀도 표면을 얻어지고 파란색 선은 노드 지점이다.
이것들은 핵으로부터 일정한 거리에서 전자를 발견할 확률이 0이고 radial 노드라 한다.
-2p 오비탈은 아령 모형인데 완전한 구가 아닌 일그러진 구라서... 2p 오비탈의 아령 한 쪽의 크기는 1A이다. 두 사이 부분은 전자 발견 확률이 0인 노달서피스이고
- p 오비탈이라 각 노드도 존재한다. 큰 구가 방사 노드를 갖고 있고 각도 있다.
- 4p 오비탈 경우 위 그림과 같이 존재할 것이다. 노드가 2개! 각과 방사 둘 다 있다.
'무기화학' 카테고리의 다른 글
| 무기화학 원자가 결합 이론 [Simple Bonding Theory] #6 (0) | 2021.12.05 |
|---|---|
| 무기화학 원자 구조 친화도, 주기 [Atomic Structure (affinity, period)] #5 (0) | 2021.12.03 |
| 무기화학 원자 구조 가리움 [Atomic Structure(shielding)] #4 (0) | 2021.12.02 |
| 무기화학 오비탈 이론 #3 (0) | 2021.12.01 |
| 무기화학 Introduction to Inorganic Chemistry #1 (0) | 2021.11.29 |