
강산과 강염기는 형식농도로 100% 쪼개져서 프로톤 수산화이온을 만들어 간단한데 약산과 약염기는 그런게 없어서 평형상수를 고려해야 하므로 어렵다... 그리고 다 쪼개지지 않으므로 100개중 1개만 쪼개지는 경우가 대부분이다. 약산의 pH 계산할 때는 강산과 달리[강산 →(한쪽방향) 프로톤(or 수산화이온)+ 금속이온(or 할로겐) ] 약산에서는 화살표가 왔다 갔다 평형의 표기를 해야 하며, 일반적인 일양성자산이기 때문에 약산의 대표적인 형태가 HA다. 쪼개지면 프로톤과 A-가 생긴다. 평형상수는 Ka= 생성물의 농도/반응물의 농도이다. 물을 고려하지 않으면 1:1로 생기니 프로톤과 A-는 농도는 동량이다. 구하고자 하는 게 pH면 [H+]를 x 로 놓고, 해리되면 [HA]는 형식 농도에서 생성된 농도 빼면 된다. [H+][A-]/ [HA] =x2/F(형식농도)-x이다.
(형식농도= 우리가 만들려고 하는 농도로 만들려면 저울질해서 해당 몰수의 양을 측정해서 용매에 녹일 것이다. 하지만 물에 녹이면 원하는 농도로 존재하지 않고 쪼개지고 남은 양이 존재하기 때문 형식농도보다 더 작은 양이 존재한다. ) 그러면 Ka, F알면 x에 대한 2차방정식이 되므로 풀면 x구하고 pH를 구한다.

여기서는 0.05M 염화 트라이메틸암모늄의 pH를 구한다. 일단 염화 트라이메틸암모늄이 산인지 염기인지 알아야 한다. 염화 트라이메틸암모늄 보고 염화 음이온이 있고 암모늄 양이온이 있으면 소금 같은 염이다. 트라이메틸암모늄이온에 염화이온이 이온결합으로 붙어 있는 형태이다. 물에 녹으면 100% 해리된다. 트라이메틸암모늄이라고 되어 있는데 그냥 암모늄이온 생각하면 된다. 암모늄 이온은 NH4+ 양이온이고, 약산으로 존재한다. (암모늄 이온만 분리할 수 없어서 염화이온을 붙여 전기적 중성인 염의 형태로 만든다. 이것을 정제를 통해 합성하고 시약 판매한다. 어차피 물에서는 암모늄 이온 넣은 것과 똑같은 결과를 주기 때문 염의 형태로 써도 지장 없다.)
먼저 평형식을 적는다.(CH3)3NH+↔(CH3)3N + H+(염화이온은 빼고 적어도 된다.) 암모늄 이온이 있고, 물에 녹으면 두 개의 암모니아[(CH3)3N= 약염기]?를 만들고 프로톤을 내놓는다. F와 Ka가 주어졌으니 근의 공식으로 2차방정식을 푼다. 약산과 약염기는 쪼개지는 양이 1%에 불과하니 x는 F의 1%도 안된다. 그래서 F-x에서 x를 생략하고 F로 놓고 풀어도 미미하다.

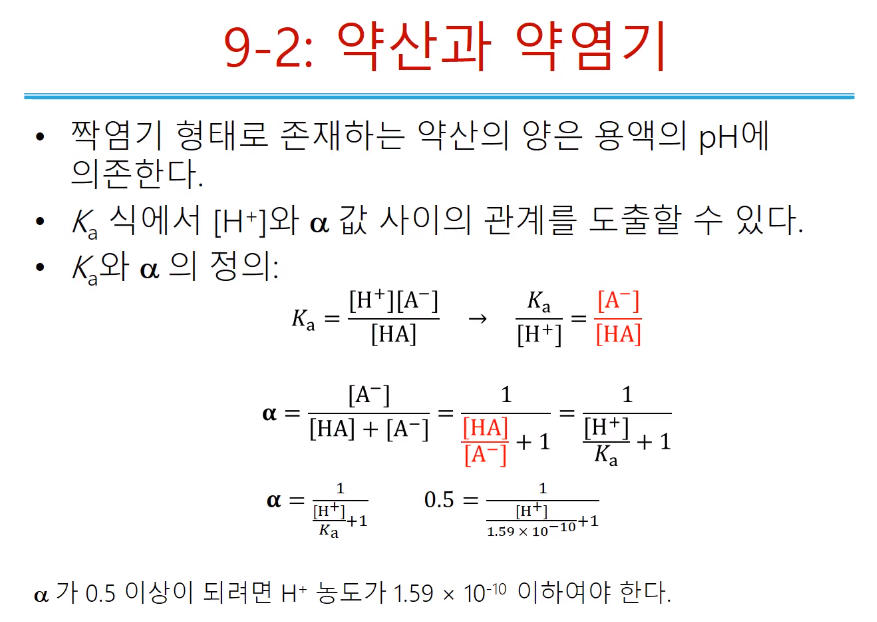
약산이 쪼개질 때 얼마만큼 쪼개지는지 해리분율을 통해 알 수 있고, 같은 약산이여도 상대적으로 누가 더 센지 해리분율로 알 수 있다. 결국은 해리분율은 전체 x(쪼개져서 생긴 양)/F(형식 농도)이고, 해리분율 정의는 파란 박스와 같다. 용액중 존재하는 전체의 양은 암모니아같으면 암모니아 / 암모니아+암모늄이온가 된다.
처음[HA]넣으면 물에 [A-]가 생기고 남은 [H+]가 있고, 두 개 합하면 처음 의도했던 형식농도이고, 쪼개진 양이[A-]가 되는 것!
강산 강염기 경우! HCl이 0.1 mol 있으면 H+ 0.1m 이 생기므로 해리분율은 x/F= 0.1 mol(생긴 프로톤)/0.1 mol(HCl)=1이 된다.

해리분율 예를 들면 위와 같다. 약산에서 F가 x 보다 훨씬 크므로 x를 생략하고 x/F로 써도 된다. 염화 트라이메틸암모늄경우 5.6 x10-5밖에 안 생긴다. 약 십만 개 중 프로톤이 1개 나오는... 매우 작다. 거의 쪼개지지 않아도 약산이라고 할 수 있다. 일반적으로 약산은 쪼개지는 게 커야 1%라는 것... 약산, 약염기, 강산, 강염기들이 녹았을 때 원래 포르말 농도에서 얼마나 쪼개지는져서 얼마의 비율을 갖는지 중요하다. 강한 것들 100%, 약한 것들 1%미만
이 슬라이드는 생략~

약염기가 녹아있는 용액이다.(약산이라고 되어 있는데 약 염기라고 고쳐야 한다.) 약 염기는 일양성자산에서 주로 B라고 쓴다. 약산이 물과 만나 염기가수분해를 해서 OH-를 만든다. 평형식에 대한 평형상수관련된 식은 위 Kb=[BH+][OH-]/[B]와 같다. 약산의 경우처럼 포르말 농도와 x 관계를 x2/F-x로 쓴다. Kb,F는 주어진 값이고 x(OH-)를 구해서 pH를 구한다. 짝산 짝염기 뭐가 약산이고 약산의 짝염기는 뭐고 이런 관계를 알아야 한다. Kb가 주어지지 않으면 Ka로 구해야 한다.

예제 보면 0.1M(=F) 암모니아 pH 구하시오! 물에 암모니아 녹일 때 평형반응 쓸 수 있어야 한다. 염기가수분해 반응이 일어나므로 NH3 + H2O ↔ NH4+ + OH- 이다. 앞에서 이야기했던 Kb식 까지 쓰고, Kb가 안 주어졌을 때 Ka가 있으면 Kb를 구해서 쓰면 된다. Ka는 어떤 반응에 대한 평형상수인가? Ka는 NH3 + H2O ↔ NH4+ + OH- 역반응이라고 생각하겠지만 아니다. 역반응은 산(암모늄 이온)과 염기(OH-)가 반응하는 중화반응이므로 Ka가 아니다. Ka는 암모늄 이온이 물이랑 만나서 하이드로늄 이온과 암모니아 내놓는 게 Ka이다. (NH4++H2O ↔ NH3 + H3O+) 두 반응을 더하면 Kb + Ka = (NH3 + H2O ↔ NH4+ + OH-) + (NH4++H2O ↔ NH3 + H3O+) 암모니아 암모니아 생략, 암모늄 암모늄 생략, 두 개의 물이 하이드로늄 이온과 수산화 이온을 내놓는 반응만 남고, 이게 Kw= 1.0 x10-14이다. 두 식을 더하면 평형상수는 서로 곱한다. Ka x Kb=Kw 고로 Kb=Kw/Ka 으로 구할 수 있다. 구하고자 하는 게 Kb면 Ka를 알아야 한다. (평형상수 Ka, Kb는 곱하고, pKa, pKb는 더하고) 식에 구한 값을 다 넣으면 x 를 구할 수 있음! 수소이온을 구하고 -log를 씨워 pH를 구한다. or pOH를 구해 14에서 뺀다.

완충작용은 중요한 용액의 성질이다. 생물체 몸에는 완충용액들이 있어서 외부로부터 산이나 염기가 들어왔을 때 몸의 항상성을 잃지 않고 정상적으로 작동하도록 도와준다. 완충용액은 생명과 관련된 실험할 때 많이 활용한다. 완충용액은 기본적으로 약산, 약염기 그의 짝염기, 짝산으로 구성되어 있다. HA ↔ H+ + A-에서 약산(HA)과 그의 짝염기(A-) 비율이 비슷하다. 약산만 있으면 그의 짝염기를 만드는 비율이 1%도 안되니... 약산만 녹이는 것으로 완충용액이 될 수 없다. 두 개가 비슷한 양으로 있어야 완충작용되지.... 99:1 비율로는 안된다. 약산과 약산의 짝염기를 따로 집어넣어 줘서 비율을 맞춰 준다. 완충용액을 만들었을 때 pH 계산하는 게 중요하다. 그때는 핸더슨 하셀 바흐 식을 사용한다. pKa(약산에 대한 산해리평형상수)+log [짝염기]/[약산] = pH가 된다. 산해리 평형상수 Ka는 HA ↔ H+ + A-에서 식에서부터 유도된 것이다. 핸더슨 하셀바흐식 유도하는 과정이 있는데 중요하다. 이 식을 자세히 살펴보면 완충용액의 pH는 사용된 약산의 산해리 평형상수에 직접적으로 관여하고, log [짝염기]/[약산]에서 짝염기 약산의 비율에 따라 달라진다. 약산이 짝염기보다 많아지면 분모가 커지고 당연 산성으로 가니 pH가 작아진다. 짝염기가 커지면 염기성으로가고 로그의 분자가 커지니 식 상으로서도 커진다. 산해리 평형상수 pKa값이 클수록 pH가 크다. 약산도 많은 종류가 있는데 고유의 Ka값이 존재한다. 그 평형상수가 클수록 녹였을 때 pH가 커진다. 평형상수가 커질수록 같은 양을 녹였을 때 프로톤을 많이 내놓는다는 뜻이고 프로톤이 많으면 당연히 pH는 낮아진다. 각 값이 커질수록 p를 붙이면 작아진다. 여기서 pKa는 로그 분모에 있는 약산의 Ka값이다.
완충용액에서는 HA와 A- 두 개를 충분한 비슷한 농도를 진하게 해서 양으로 섞는다. 강산 강염기가 들어와도 남아있는 HA와 A- 의 양은 크게 변하지 않는다.
Ex) 전쟁시 군사 훈련 10000만 시킨다. 적이 오면 군사들의 희생이 있을 텐데 적이100명이면 10000만에서 100명 뺀 양은 미미하므로 10000만이라고 봐도 된다. 이런 원리로 완충작용이 된다.

문제가 잘 못 된 거 같은데,,, 하이포아염소산 소듐으로 구성된 완충용액의 pH는 6.20라고 변경해야 한다. NaOCl은 물에 녹으면 염기이므로 짝산(HOCl)이 있으니 짝산 짝염기가 들어있는 완충용액이라고 말하고 그것의 pH는 6.2라고 해야 한다. 이 용액에서 짝염기/약산 비를 구한다. 비를 구하는 것이므로 핸더슨 하셀 바흐식을 사용하면 된다. 풀이처럼 구하면 되고 pKa는 약산 [HOCl]의 값이다. (HOCl →H++OCl-)에 대한 값이다.
언제 이런 비 개념이 쓰이냐면 완충용액을 물로 묽힐 때가 있다. 묽히면 각 농도는 묽어지는데 묽히기 전후 짝염기/약산 비율은 여전히 같으므로 pH는 변하지 않는다. 물을 쫄여 진하게, 물을 넣어 묽혀도 pH가 바뀌지 않는데 엄밀하게 하면 활동도를 쓰면 묽을 때, 진할 때 따라 활동도 계수가 변하므로 pH가 바뀐다. 시험 문제에서 활동도 고려하라 하면 활동도 적용해서 비율 바뀌는 것을 구해야 한다.
'분석화학' 카테고리의 다른 글
| 분석화학 다양성자성 산-염기 평형(아미노산 루신) #40 (0) | 2021.11.01 |
|---|---|
| 분석화학 다양성자성 산-염기 평형(아미노산 루신) #39 (0) | 2021.10.31 |
| 분석화학 일양성자성 산-염기 평형(강산과 강염기) #36 (0) | 2021.10.28 |
| 분석화학 활동도와 평형의 체계적 처리(질량 균형) #35 (0) | 2021.10.27 |
| 분석화학 활동도와 평형의 체계적 처리 #34 (1) | 2021.10.26 |