
약산약염기의 형태! 종류 많다.
강산 강염기보다 더 많다.
약산의 형태는 전하로 봤을 때 중성과 전하를 띤 상태로 분류한다.
중성은 아세트산!, 아질산!
약산은 물을 만나면 하이드로늄 이온을 만들고 본인은 해리된다. 약산의 짝염기는 A-라는 물질이다.
약산의 대표 형태는 일반적으로 'HA'로 표기한다. 짝염기는 A-로 표기!
전하를 띤 것은 중성자 염기성 물질에 양성자(H+)가 붙은 물질로 암모니아! NH3에 H+가 붙으면 NH4+ 암모늄이온! 약산이다!
전하를 띠는 것은 BH+가 물을 만나면 프로톤 전달하여 하이드로늄 이온 만들고 B만 남는다.
암모늄 이온을 사려면 이온 형태로 살 수 있는 것은 없다. 항상 양이온이면 음이온이 붙은 염 형태로 살 수 있다.
암모늄 이온 경우 NH4Cl 형태! 물에 넣으면 100% 해리하기 때문에 암모늄 이온이 된다.
100% 해리돼도 NH4+ 가 생기는 것이지 하이드로늄 이온이 생기는 게 아니다.
100개 쪼개지면 100개 Cl- , NH4+ 만들어지고 NH4+100개 중 1개, 1000 중 1개만 양성자 내놓고 짝염기가 된다.
용액을 보면 약산의 경우 일부만 프로톤을 내놓기 때문에 원래 형태 (BH+)가 짝염기 형태보다 더 많다.
약산의 경우 화살표도 길이가 같은 ↔ 일방적인 한 방향으로 표시하지 않고 양쪽의 평형상태를 나타낸다.
강산인 경우 일방적인 정방향으로 화살표 → 표시를 한다.
NH4Cl 약산 기억해야 한다! HN(CH3)3Cl 이경우 물에 녹으면 트라이 메틸 암모늄 이온이 만들어진다.
암모늄(암모니아에 프로톤 붙은 것) 화합물은 산이고, 프로톤 떨어지면 아민으로 염기가 된다.
( HN(CH3)3 +(암모늄 이온)에서 프로톤이 떨어지면 N(CH3)3 (아민)으로 염기가 된다. ... 암모니아도 아민이다.)

염기의 형태!
중성 암모니아(pH가 중성이 아니라 전하! 전하를 띠지 않는 형태!!!)로 암모니아, 트라이메틸아민이 있다.
전하를 띤 것은 이온 형태이다. 약산에서는 암모늄 이온, 약염기에서는 HA(ex. 아세트산)에서 H+가 떨어지고 A-(ex. 아세트산 음이온)이다.
염기도 이온 형태로 살 수 없고, 염의 형태로 아세트산 소듐, 프탈산 포타슘 살 수 있다.
물에 녹이면 100%다 해리되고 100개를 녹이면 100개의 소듐 이온과 아세트산 음이온이 생기고,
100개 아세트산 음이온 중 1개 정도가 물과 반응해서 OH-를내 놓는다.(100개 중 1개만 물과 반응해 수산화 이온을 내놓으니 약염기다.)
명명 시 끝에 ate 붙인다. 포타슘 프탈레이트, 소듐 아세테이트 등!
트라이 메틸 아민에 프로톤 하나가 붙으면 트라이 메틸 암모늄 형태의 약산이 된다.

앞에서는 1 양성자산 내놓을 수 있는 프로톤과 받을 수 있는 프로톤이 1개씩, 두 개 이상일 때는 다양성자성 산과 염기이다.
트라이 프로틱한 인산이 물을 만나면 수소를 내서 이온상태로 다이 하이드로젠 포스페이트, 하이드로젠 포스페이트, 포스페이트가 된다.
평형상수를 보면 10만 배씩 작아진다. 그만큼 첫 번째 프로톤 많이 가지고 있을 때 반응은, 프로톤 조금 갖고 있을 때 보다 평형상수가 크다.
즉, 프로톤 내놓기 쉽다. 수소를 많이 갖고 있으니 하나 정도야 내놓기 쉬운데 갈수록 어려워진다.
다양성자성 염기(양성자 없는데? 다양성자성?...프로톤을 여러 번 받아들여서 그런가?)는 인산에서 짝염기 될 수 있는 것들이 해당된다.
포스페이트가 물과 반응하면 하이드로젠 포스페이트가 되고, 또 하면 다이 하이드로젠 포스페이트가 된다.
위처럼 반응성은 밑으로 갈수록 10만 배씩 줄어든다. 그 말은 포스페이트가 가장 강한 염기다.
프로톤이 하나도 없다가 프로톤을 먹어야 배부르다면.... 한 개 먹고 다면 배 좀 차서 먹고 싶은 생각이 줄어드는 것과 비슷하다.
둘 다 공통점은 물과 만나는 반응에서 수소이온 또는 수산화이온을 내놓는다.
약산, 약염기의 성질을 말할 때 얼마나 프로톤, 수산화이온 잘 내놓느냐 얘기할 때
산하고 물하고 만나는 반응을 쓰고 평형상수를 통해 알 수 있다.
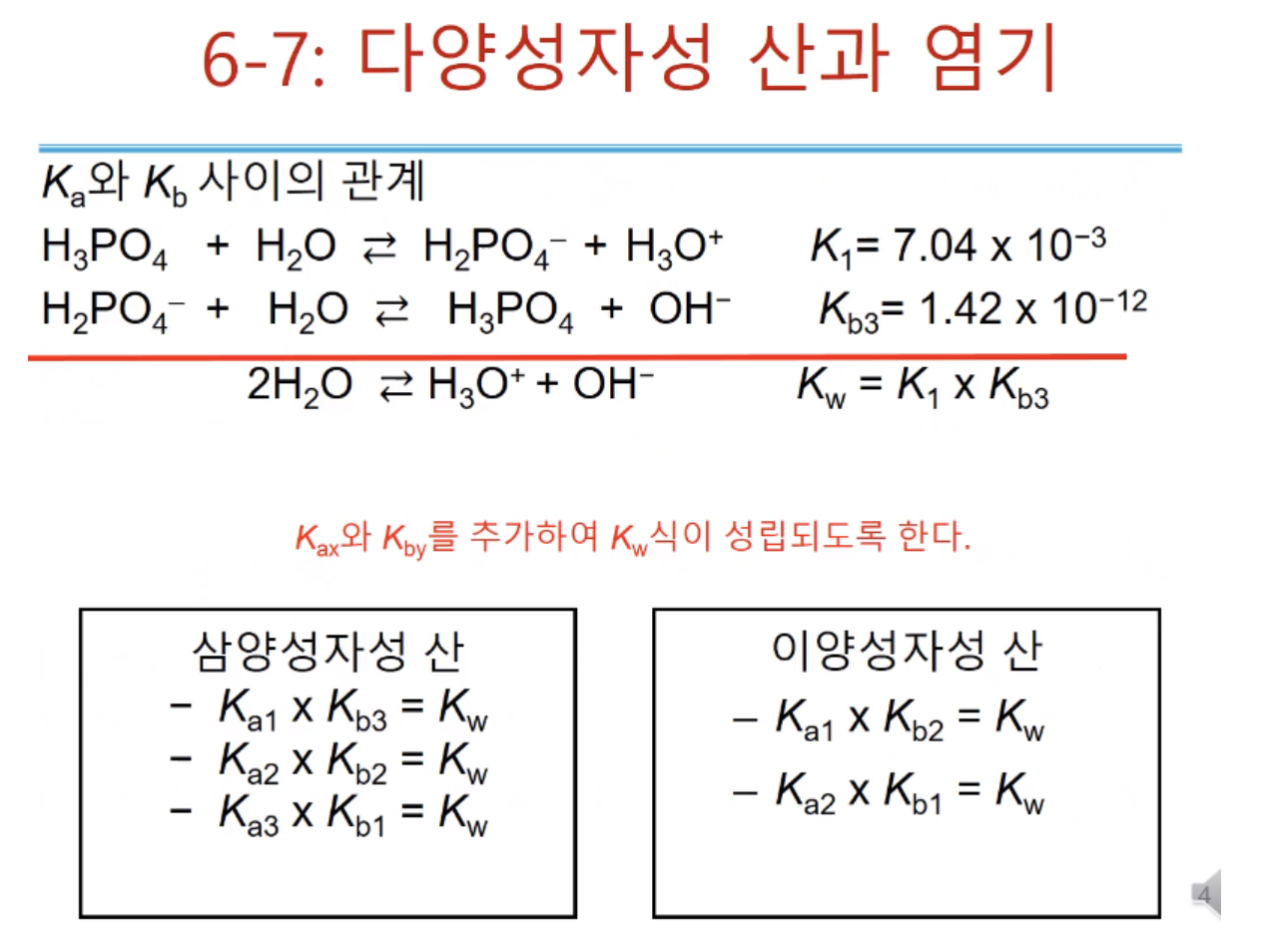
K1 은 산으로 트라이 프로틱 인산, Kb3 은 염기로 작용하고 다이 하이드로젠 포스페이트 가 물을 만나는 반응식이다.
두 식을 더하면 2개 물과 하드로늄 이온, 수산화 이온만 남는다. 물의 자동 이온화 반응이고 이 반응 상수는 Kw이다.
이러한 방식으로 위 박스의 식을 얻을 수 있다.
이걸 알고 있으면 K1을 알면 Kb3를 구할 수 있다.(Kw=1014)


화합물 구조를 쓸 때 유용한 거! 유기화학에서 배운거당 구조식 그릴 때 생략하거나 추가하는 게 있다.
1. 꺾어진 거 볼 때 CH2 생략, 2. CH 생략, CH아닌경우 구별하기 위해 OH와 H 입체적인 것은 추가한다.
'분석화학' 카테고리의 다른 글
| 분석화학 침전 적정 #27 (0) | 2021.10.19 |
|---|---|
| 분석화학 적정 #26 (2) | 2021.10.18 |
| 분석화학 화학평형(브뢴스테드로우리 산염기평형) #25 (0) | 2021.10.16 |
| 분석화학 화학평형(착물형성) #24 (0) | 2021.10.15 |
| 분석화학 공통이온 효과 #23 (0) | 2021.10.14 |